Tinción de hematoxilina-eosina: características, usos, técnicas
La tinción de hematoxilina – eosina es una técnica de coloración que utiliza la combinación de los colorantes hematoxilina y eosina. Este par de colorantes hacen un dúo perfecto, ya que la hematoxilina actúa como un colorante básico y la eosina es un colorante ácido.
La designación de colorantes básicos o ácidos no se refiere al pH que obtienen en solución, sino más bien habla de la proporción que prevalece en cuanto a las cargas aniónicas o catiónicas que poseen o por la ubicación del grupo cromóforo.
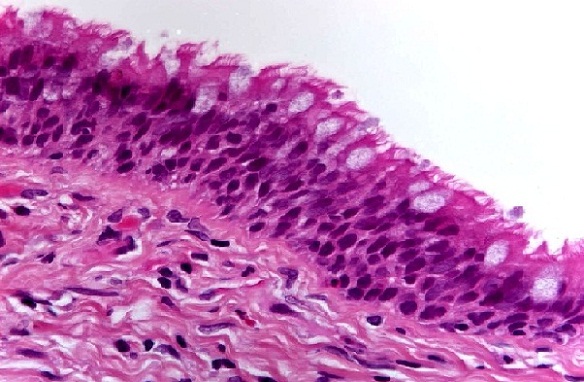
En este sentido, la hematoxilina es considerado un colorante básico (catiónico) y por ello tiene afinidad por las estructuras ácidas, como por ejemplo el núcleo de las células. Mientras que la eosina al ser un colorante ácido (aniónico) tiene afinidad por las estructuras alcalinas o básicas, como el citoplasma celular.
Por esta razón, esta combinación de colorantes es muy utilizada para la tinción de tejidos, pues permite distinguir claramente los núcleos y los citoplasmas. Los núcleos se tiñen de color azul oscuro o púrpura y el citoplasma de rosado.
La tinción hematoxilina-eosina es una de las técnicas de coloración más utilizadas en el área de histología y citología, por su fácil manejo y bajo costo. Se utiliza para la visualización de células, fibras nerviosas gruesas y la presencia de ciertos microorganismos en los tejidos, tales como: parásitos, hongos y bacterias, entre otros.
Índice del artículo
La hematoxilina es un colorante neutro. Sin embargo, el componente que proporciona el color (cromóforo) está ubicado en el centro catiónico o básico de la molécula. De allí su afinidad por las estructuras ácidas. Su fórmula química es C16H14O6 y su nombre científico 7,11b-dihydroindeno [2,1-c] chromene-3, 4,6a, 9,10 (6H)-pentol.
Tiñe principalmente los núcleos de las células, ya que estos son muy ricos en ácidos nucleícos. También puede teñir inclusiones citoplasmáticas de origen viral.
Para que la hematoxilina pueda teñir debe estar en estado oxidado y unido a un metal. Este último servirá para fijarse al tejido, es decir, actuará como mordiente.
Cuando la hematoxilina se oxida se denomina hemateína. La oxidación se consigue por la exposición al oxígeno (envejecimiento) del reactivo o por sustancias que ayudan a su oxidación (oxidación química).
La eosina es un colorante que tiñe de color rojo o rosado. Es insoluble en agua aunque hay una versión hidrosoluble. Generalmente, la eosina se prepara disolviendo en alcohol (etanol al 95°).
Tiñe citoplasmas, fibras musculares, organelos citoplasmáticos y colágeno, pero no tiñe los núcleos celulares. Esto es debido a que se encuentra cargada de forma negativa, por tanto, tiene afinidad por las estructuras cargadas positivamente.
Existen dos tipos de eosina la “Y” y la “B”. La eosina “Y” se le conoce como eosina amarilla. Su nombre científico es tetrabromofluoresceína y su fórmula química es C20H8Br4O5.
Por otra parte, la eosina “B” es a veces denominada eritrosina B azulada. Su nombre científico es dibromodinitrofluoresceína y la fórmula es C20H8Br2N2O9. Ambas son muy similares y realmente no es perceptible la diferencia de utilizar una u otra. Sin embargo, la más popular es la eosina “Y”.
La eosina tiene la propiedad de distinguir entre una célula viva y una muerta, pues solo es capaz de atravesar la membrana para teñir su citoplasma cuando las células están muertas, quedando el citoplasma de la célula incolora si esta permanece viva.
Con hematoxilina-eosina se pueden teñir e identificar las fibras nerviosas gruesas. Sin embargo, no es útil para colorear las fibras nerviosas delgadas, pues para poder visualizar estas últimas se necesita una coloración de plata.
En las tinciones de la capa córnea de la piel el colorante que actúa es la eosina, ya que a este nivel las células no poseen núcleo.
En la capa granulosa de la piel, la hematoxilina tiñe fuertemente a los gránulos de queratohialina que se encuentran en el interior de las células granulosas. Por el contrario, el estrato espinoso de la piel es teñido débilmente con la hematoxilina, mientras que la capa basal o germinal si se tiñe bastante.
La eosina tiñe el citoplasma de todas las células y la intensidad del color puede variar entre una capa y otra.
Gómez y colaboradores, en 2005 demostraron que la tinción con hematoxilina –eosina fue más eficaz para identificar casos de amibiasis por Entamoeba histolytica y Entamoeba dispar que el método de visualización al fresco (solución salina y lugol) en pacientes con enfermedad diarreica aguda.
También se demostró que tiene gran sensibilidad para detectar eritrofagocitosis (amebas que han fagocitado eritrocitos).
Walwyn y colaboradores, en 2004 propusieron el uso de tinciones histológicas para detectar microorganismos causantes de infecciones.
Utilizando la coloración de hematoxilina-eosina lograron visualizar infecciones causadas por Clostridium, Actinomyces, espirilos o Candida. También lograron observar presencia del parásito Sarcoptes escabiei en cortes de piel e inclusiones virales por citomegalovirus y herpes en cortes de diversos tejidos.
La tinción de cortes histológicos pasa por una serie de pasos. Lo primero es la obtención del corte histológico. Este debe ser parafinado para luego obtener los cortes (ultra-finos) con un micrótomo. La técnica consta de los siguientes pasos:
1-Eliminación del exceso de parafina: para ello se puede utilizar xilol o Hemo –D, sumergir por 3-5 minutos.
2-Rehidratación de la muestra: esto se logra sumergiendo la muestra en distintas concentraciones de alcoholes (etanol) en orden descendente (100°, 90°, 70°). En todos los casos por 7 minutos.
3-Eliminación del exceso de alcohol: para ello se sumerge en agua por 7 minutos.
4-Coloración con hematoxilina: la muestra se sumerge por 6-10 minutos en una bandeja que contiene hematoxilina. El tiempo de exposición depende del tamaño y grosor de la muestra.
5-Eliminación del exceso de hematoxilina: se lava con agua por 5 minutos y luego se realiza un pasaje rápido (10-20 segundos) por alcohol ácido. Posteriormente se lava con agua nuevamente por 5 minutos. Luego se sumerge en etanol a 96° por 1 minuto.
6-Coloración con eosina: para ello se sumerge la muestra por 5 minutos en la bandeja de eosina.
7-Deshidratación de la muestra: para ello se vuelve a pasar por las bandejas de alcoholes (etanol), pero esta vez en orden ascendente. (70°, 90°, 100°). (Por 5 segundos, 5 segundos, 1 minuto respectivamente).
8-Clarificación de la muestra: para ello se expone al xilol por 5-10 minutos y se seca para sellar de forma definitiva con bálsamo de Canadá u otro material similar.
En una laminilla se realiza un extendido con las heces del paciente y se fija con alcohol al 80% durante 5 minutos. La lámina se sumerge en hematoxilina por 5 minutos e inmediatamente se lava con agua.
Posteriormente, se sumerge rápidamente en alcohol ácido y luego en agua amoniacal. Se lava con agua. Se colorea por 5 minutos en eosina. Se deshidrata la muestra como fue explicado en la técnica anterior y finalmente se aclara con xileno.
En un litro de agua destilada disolver 50 gramos de sulfato alumínico potásico o de amonio. Cuando esté completamente disuelto, agregar 1 gramo de hematoxilina cristalizada. Al disolver en su totalidad, se adiciona 1 gr de ácido cítrico junto a 50 gr de hidrato de cloral y 0,2 gr de yodato de sodio.
La mezcla se hierve por 5 minutos, luego se deja enfriar y se filtra para eliminar las partículas sólidas que hayan quedado. El reactivo así preparado puede ser usado inmediatamente.
Se puede preparar con base alcohólica o con base acuosa.
Eosina alcohólica
En 100 ml de etanol a 95° disolver 0,5 gramos de eosina “Y”. Luego adicionar unas gotas de ácido acético glacial.
Eosina acuosa al 2%
En 1250 ml de agua destilada disolver 25 gramos de eosina “Y” hidrosoluble. Luego adicionar unas gotas de ácido acético glacial.
Alcohol ácido
Medir 0,5 ml de ácido clorhídrico concentrado y completar a 100 ml con alcohol absoluto.
Agua amoniacal
Medir 0.5 mL de amoníaco concentrado y completar a 100 mL con agua destilada.
- Navarrete, G. Histología de la piel. Rev Fac Med UNAM 2003; 46 (4): 130-133. Disponible en: medigraphic.com
- Gómez-Rivera N, Molina A, García M, Castillo J, Castillo J, García R, Fonseca I, Valenzuela O.
- Identificación de la Entamoeba histolytica/E. dispar por la técnica de amiba en fresco vs su tinción con hematoxilina-eosina en la diarrea aguda. Rev Mex Pediatr 2005; 72(3); 109-112. Disponible en: medigraphic.com
- Walwyn V, Iglesias M, Almarales M, Acosta N, Mera A, Cabrejas M. Utilidad de técnicas histológicas para el diagnóstico de infección en piezas anatómicas. Rev Cub Med Mil, 2004; 33 (2). Disponible en: scielo.sld
- PanReac AppliChem ITW Reagents. Tinción hematoxilina-eosina. 2017, España. Disponible en: itwreagents.com
- “Eosina.” Wikipedia, La enciclopedia libre. 7 nov 2018, 08:18 UTC. 4 ago 2019, 22:13 es.wikipedia.org
- “Hematoxilina.” Wikipedia, La enciclopedia libre. 3 may 2019, 11:23 UTC. 4 ago 2019, 22:48 wikipedia.org
