Tinción de cápsula: fundamento y técnicas
La tinción de cápsula es una técnica de coloración diferencial que tiene la propiedad de resaltar la estructura polisacárida que rodea a ciertas bacterias y levaduras denominada cápsula. Se utiliza en los laboratorios clínicos para ayudar al diagnóstico de ciertas patologías originadas por microorganismos capsulados.
También se utiliza en laboratorios de docencia para la demostración de esta estructura morfológica a estudiantes de carreras de ciencias de la salud, tales como: medicina, bioanálisis, enfermería, o citotecnología, entre otras.
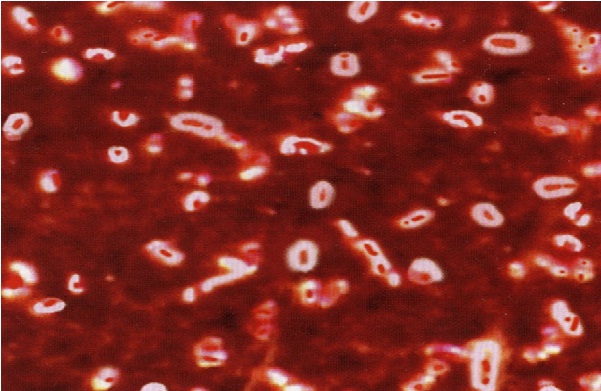
Existen varias técnicas sencillas para demostrar la presencia de la cápsula en los microorganismos que la poseen, estas son: la tinción negativa, la tinción de Anthony y una variante que combina las dos anteriores.
La tinción negativa se utiliza principalmente en muestras de LCR cuando se sospecha la presencia de la levadura Cryptococcus neoformans. Esta levadura es una causa frecuente de meningitis.
Esta técnica utiliza nigrosina o tinta china y se fundamenta en crear un contraste entre el fondo del preparado y la cápsula impenetrable del microorganismo. El fondo se tiñe de oscuro y la cápsula queda incolora. De esta manera se pone en evidencia esta estructura.
En cuanto a la técnica de Anthony se puede decir que es mayormente utilizada en laboratorios de docencia para demostrar la estructura polisacárida en bacterias como Klebsiella pneumoniae, Streptococcus pneumoniae y Neisseria meningitidis.
El uso de esta técnica para fines diagnósticos es muy poco frecuente, ya que existen otras pruebas de rutina que permiten identificar a estos microorganismos.
Índice del artículo
La cápsula es una estructura fuerte de naturaleza polisacárida. Esta protege a los microorganismos de la fagocitosis, y por tanto es una estructura difícil de penetrar.
Es por ello que las tinciones de cápsulas se fundamentan en el contraste. Los colorantes tiñen el fondo de la preparación mientras que la cápsula queda incolora.
Por tanto, con estas técnicas la cápsula es fácilmente reconocible. Si el microorganismo no posee cápsula no será distinguible con este tipo de coloración, porque todo se teñirá del mismo color.
Todas las técnicas que se utilizan para colorear la cápsula poseen el mismo fundamento a pesar de que utilizan colorantes y procedimientos diferentes.
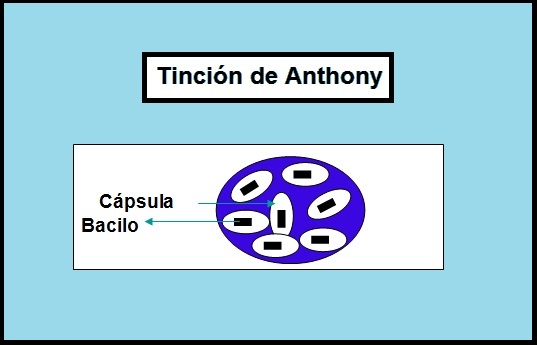
La tinción de Anthony utiliza como colorante al cristal violeta. Este teñirá el cuerpo bacteriano y el fondo de color violeta.
Por otra parte, se utiliza sulfato de cobre al 20%. Este sirve de solución de lavado, es decir, quita el exceso de cristal violeta de la preparación, haciendo que las cápsulas se aclaren pero sin que el cuerpo bacteriano ni el fondo pierdan el color.
Materiales
– Leche tornasolada.
– Lámina portaobjeto.
– Cristal violeta al 1%.
– Sulfato de cobre al 20%.
– Microscopio óptico.
– Aceite de inmersión.
Procedimiento
Esta técnica consiste en:
- Cultivar el microorganismo en leche tornasolada por 36 horas.
- Colocar una gota del cultivo en el extremo de una lámina porta objetos y al lado colocar una gota de cristal violeta, mezclar y extender con el extremo de otro portaobjetos.
- Secar al aire libre y no fijar al calor.
- Lavar con solución de sulfato de cobre al 20%, dejar secar al aire libre.
- Observar al microscopio con objetivo de inmersión. Buscar hacia los extremos del extendido.
Es importante no utilizar calor ni para fijar, ni para secar, ya que ello daña la cápsula. Tampoco lavar con agua.
Interpretación
La leche tornasolada es un excelente medio de cultivo ya que proporciona los nutrientes necesarios para que el microorganismo desarrolle una cápsula prominente.
Por otra parte, la leche tornasolada formará un fondo grueso y compacto que se teñirá de violeta junto con el cuerpo bacteriano, pero la cápsula que rodea al microorganismo quedará incolora. Por tanto, se observa un halo claro alrededor del cuerpo bacteriano.
Ventajas
Es una técnica sencilla de realizar. No requiere fijación.
Así mismo, cabe destacar que se pueden usar otros medios de cultivo, pero se prefiere el medio con leche porque tiene la ventaja de que proporciona cápsulas más prominentes.
Desventajas
Es una técnica un poco más laboriosa que la tinción negativa, y para su visualización requiere esperar a que la preparación se seque completamente.
Materiales
– Láminas portaobjetos.
– Medio de cultivo con el microorganismo.
– Tinta China o nigrosina.
– Microscopio óptico.
– Solución salina fisiológica.
Procedimiento
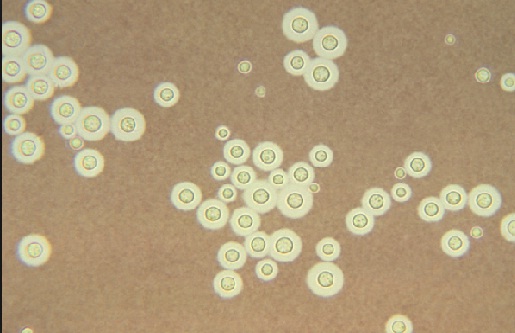
Colocar una gota de solución salina fisiológica sobre el cubreobjetos y disolver una pequeña porción del cultivo microbiano. Es importante que la preparación no quede muy gruesa. Luego colocar una gota de tinta China o nigrosina y mezclar.
Después se coloca una lámina cubreobjetos sobre la preparación sin que se rebase el líquido. Se observa al microscopio enfocando primero en objetivo de 10X y luego se pasa a 40X.
Esta técnica también se puede usar sobre muestras de LCR de forma directa. Es decir, en vez de colocar una gota de cultivo microbiano se coloca una gota de LCR.
Ventajas
Es un método sencillo de realizar y a la vez económico. No requiere fijación, ni secado de la preparación.
Desventajas
Tiene como desventaja que debe observarse al microscopio antes de que la preparación se seque, pues si esto ocurre los microorganismos se contraerán, lo que dificultará la visualización.
Por otra parte, se pueden presentar falsos positivos si el analista es inexperto, pues los leucocitos suelen confundirse con las levaduras.
La observación de levaduras con cápsula con la técnica de tinta China o nigrosina debe ser considerado como un diagnóstico presuntivo de Cryptococcus neoformans hasta que sea demostrado con el cultivo.
Esto se debe a que existen otras levaduras que pudieran ser la causa de la meningitis y no solo el Cryptococcus neoformans, tales como las del género Candida y Rhodotorula, así como otras especies de Cryptococcus.
Interpretación
Si existen microorganismos capsulados se observará un fondo oscuro, con cuerpos transparentes flotando en el líquido, poniéndose en evidencia la presencia de la cápsula.
Esta técnica también se puede realizar con nigrosina. Es una combinación de las técnicas anteriormente explicadas. Esta técnica utiliza cristal violeta y tinta india o nigrosina.
El cuerpo bacteriano toma el color púrpura del cristal violeta debido a que está cargado negativamente, en tanto que la nigrosina colorea el fondo del frotis. Si la bacteria tiene cápsula, esta se verá como un halo trasparente alrededor del microorganismo.
El cristal violeta puede ser sustituido por cualquiera de estas coloraciones: safranina, fucsina básica o azul de metileno.
Materiales
– Cristal violeta.
– Nigrosina o tinta India.
– Láminas portaobjetos.
– Microscopio.
Procedimiento
– Cultivar el microorganismo en un medio de cultivo.
– Colocar una gota del cultivo en el extremo de una lámina portaobjetos y al lado colocar una gota de cristal tinta india o nigrosina, mezclar y extender con el extremo de otro portaobjeto.
– Secar al aire y no fijar al calor.
– Cubrir con una solución de cristal violeta por 1 minuto, lavar con agua destilada pero con mucha delicadeza (chorro suave), dejar secar al aire libre.
– Observar al microscopio con objetivo de inmersión. Buscar hacia los extremos del extendido.
Interpretación
Se observará un cuerpo bacteriano color violeta y un fondo oscuro. La cápsula, si está presente, se verá incolora alrededor de la bacteria.
- Covadonga A, Silóniz M, Serrano S. Técnicas básicas de Microbiología. Observación de bacterias. Reduca (Biología). Serie Microbiología. 2010; 3 (5): 15-38. D
- López-Jácome L, Hernández-Durán M, Colín-Castro C, Ortega-Peña S, Cerón-González G, Franco-Cendejas R. Las tinciones básicas en el laboratorio de microbiología. Mediagraphic.org. 2014; 3 (1): 10-18. Disponible en: medigraphic.com
- Gil M. Tinción negativa: fundamento, técnica, ventajas y desventajas. Lifeder.com.
- Forbes B, Sahm D, Weissfeld A. 2009. Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Argentina. Editorial Panamericana S.A
- Tankeshwar A. Capsule Stain: Principle, Procedure and Results. 2019. Medical Microbiology Guide. Available in: microbeonline.com
