Sustitución electrofílica aromática: mecanismo y ejemplos
La sustitución electrofílica aromática (SEAr) es una reacción orgánica en la que una especie pobre en electrones, es decir, un electrófilo, sustituye a uno de los hidrógenos de un anillo aromático. Esta reacción se contrapone a las adiciones que sufren los alquenos, demostrando el efecto de la aromaticidad sobre las reactividades del benceno y sus derivados.
El electrófilo, muchas veces, se genera durante el mismo mecanismo molecular, producto de la mezcla de los reactivos y un catalizador, el cual consiste en un ácido de Lewis, por ejemplo AlCl3 o FeCl3. Estos catalizadores incrementan la avidez del electrófilo por los electrones del anillo aromático, acelerando por consiguiente la reacción.
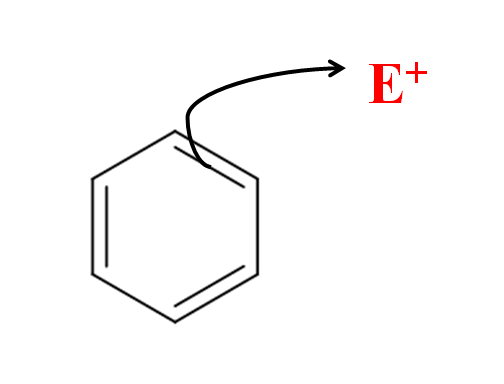
En la imagen superior tenemos una representación simple del ataque electrofílico del benceno hacia el electrófilo E+. Nótese que el ataque proviene de los electrones de uno de sus dobles enlaces; es decir, son los electrones del sistema π conjugado los que inician la SEAr.
Esta reacción hace posible que el benceno y otros compuestos aromáticos adquieran sustituyentes como los grupos OH, NO2, SO3H, Cl, Br, R, COR, COCH3, entre otros. Por ejemplo, el fenol se sintetiza vía SEAr partiendo del benceno y otros derivados.
Índice del artículo
- 1 Mecanismo de sustitución electrofílica aromática
- 2 Ejemplos de sustitución electrofílica aromática
- 3 Referencias
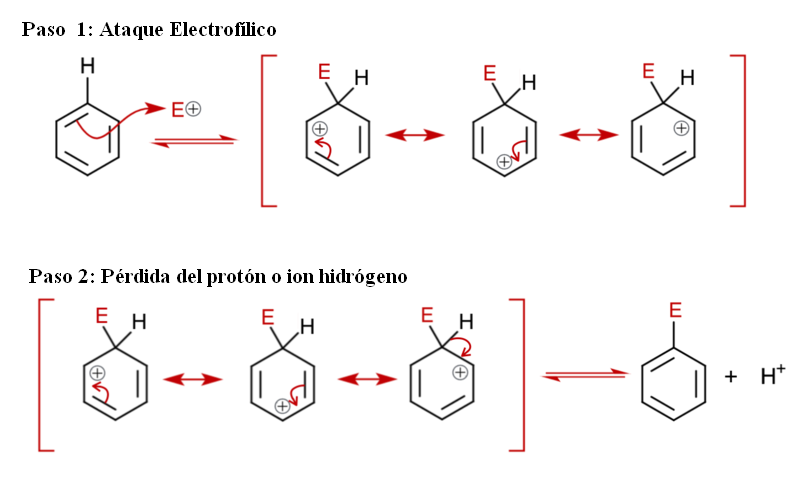
En la imagen superior se representa con más detalle el mecanismo de la sustitución electrofílica aromática. Cualquiera de los tres dobles enlaces del benceno ataca al electrófilo E+, para formar una especie intermediaria conocida como ion arenio (ciclohexadienil deslocalizado), encerrada entre corchetes rojos.
Nótese que la carga positiva de E+ ahora se traslada al interior del anillo. Pero no solo eso: se deslocaliza entre tres átomos de carbono en posiciones orto (contiguas) y para (opuestas) al carbono enlazado a E (C-E). Este intermediario existe precisamente gracias a la estabilidad que le confiere sus estructuras de resonancia.
No obstante, el ion arenio pronto debe neutralizar su carga positiva mediante la pérdida de un protón o ion hidrógeno. Es aquí donde la sustitución culmina. El electrófilo E+ sustituye por lo tanto a uno de los hidrógenos del benceno, saliendo este como ion H+ fuera del anillo, de manera que las cargas positivas se conservan.
Si se observa con detenimiento, todos los pasos se encuentran en equilibrio, por lo que la sustitución es reversible. Es decir, que si se incrementan las concentraciones del H+, entonces un hidrógeno sustituirá a E y obtendremos de nuevo los reactivos.
La SEAr del benceno es la más simple de todas, representada ya arriba. Cualquiera de los hidrógenos puede ser sustituido por E+, debido a que todos son químicamente equivalentes.
No hay diferencias entre sí. Por lo tanto, la probabilidad de que la sustitución se dé en uno de los seis átomos de carbono es la misma. Sin embargo, todo cambia cuando en el anillo bencénico hay otros sustituyentes presentes, como veremos a continuación.
Ataques orto, para y meta
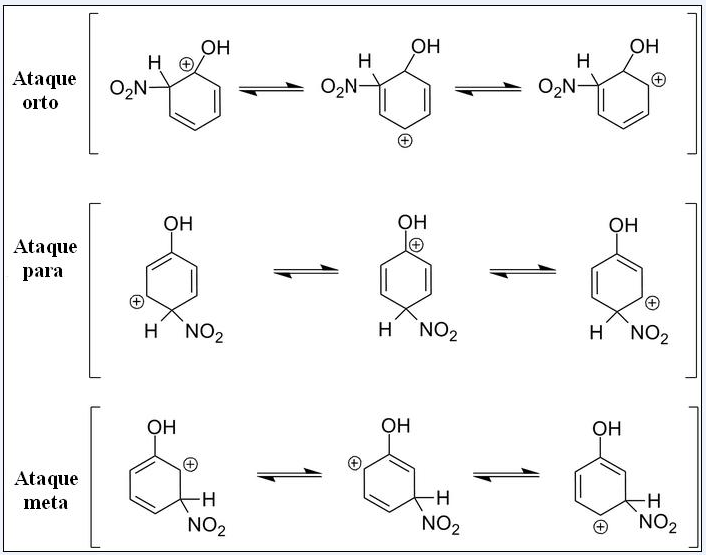
Considérese ahora la SEAr para el fenol. Esta vez, el electrófilo es el catión nitronio, NO2+, el cual al enlazarse al anillo bencénico se transforma en el grupo nitro, -NO2.
Ahora que está presente un grupo OH, los demás hidrógenos dejan de ser químicamente equivalentes; unos son más susceptibles a ser sustituidos que otros. Y además, el OH ejerce una influencia directa en este punto.
Arriba tenemos tres sustituciones en diferentes posiciones relativas al OH: ataques orto, para y meta. Nótese que en las tres tenemos el catión arenio y sus estructuras de resonancia. En los ataques orto y para, la carga positiva dentro del anillo bencénico se sitúa justo en el carbono enlazado al OH; mientras que en el ataque meta, esto no ocurre.
OH como grupo orto y para director
El OH presenta la capacidad de ceder electrones hacia el anillo vía resonancia e inducción. En ambas, puede ayudar a “disipar” la carga positiva en el carbono con que está enlazado, estabilizando en consecuencia la estructura. Por el contrario, cuando se da el ataque meta, el OH no puede estabilizar la carga positiva de la misma manera, siendo más inestable la estructura.
Por lo tanto, los ataques orto y para se ven más favorecidos energéticamente. Se dice entonces que el OH es un grupo orto-para director, que puede además activar el anillo bencénico hacia la SEAr. Es decir, que el fenol reacciona mucho más rápido que el benceno, lo cual se demuestra midiendo las velocidades de reacción.

El caso de las arilaminas, como el de la anilina (imagen superior), es similar al del fenol. Nótese que en su mecanismo esta vez sí se muestra la estabilización de la carga positiva sobre el átomo de nitrógeno (H2N+=), ayudando a que la sustitución se oriente hacia las posiciones orto y para, tal como sucede con el OH.
Ahora bien, la anilina es más reactiva que el fenol frente a la sustitución electrofílica. ¿Por qué? Porque el átomo de nitrógeno es menos electronegativo que el del oxígeno, razón por la cual cede su par de electrones libres con mayor facilidad al anillo aromático. El oxígeno, por ser más electronegativo, cede uno de sus pares de electrones con menos “avidez”.
Asimismo, el radio atómico del nitrógeno es más cercano en tamaño al del carbono. Esto repercute en el hecho de que la resonancia tiene lugar especialmente entre átomos con radios o tamaños similares. Por lo tanto, la resonancia entre el carbono y el nitrógeno es un poco más estable y eficiente que la que ocurre entre el carbono y el oxígeno.
En el clorobenceno, por otra parte, el átomo de Cl ralentiza la sustitución debido a su electronegatividad. Y aunque también es capaz de donar electrones por resonancia hacia el anillo, su radio atómico es considerablemente más grande que el del carbono, disminuyendo por lo tanto dicha aportación electrónica.
Como respuesta, el clorobenceno reacciona 50 veces más lento que el benceno, pues su anillo se encuentra desactivado a causa del cloro. Y además, al atraer electrones hacia sí, el cloro es un grupo meta director, por lo que las sustituciones ocurrirán predominantemente en esa posición.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Aromatic compound. Recuperado de: en.wikipedia.org
- Ed Vitz et al. (08 de septiembre de 2020). Aromatic Hydrocarbons. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Wyman Elizabeth. (2020). Aromatic Hydrocarbons: Definition, Examples & Uses. Study. Recuperado de: study.com
- Boluda, C. J., Macías, M., & González Marrero, J. (2019). La complejidad química de las gasolinas de automoción. Ciencia, Ingenierías y Aplicaciones, 2(2), 51-79. Doi: doi.org/10.22206/cyap.2019.v2i2.pp51-79
