Óxidos: qué son: nomenclatura, tipos, propiedades, formación, ejemplos

¿Qué son los óxidos?
Los óxidos son una familia de compuestos binarios donde hay interacciones entre el elemento y el oxígeno. De modo que un óxido tiene una fórmula muy general del tipo EO, donde E es cualquier elemento.
Dependiendo de muchos factores, como la naturaleza electrónica de E, su radio iónico, y sus valencias, pueden formarse diversos tipos de óxidos. Algunos son muy simples, y otros, como el Pb3O4 (denominado minio, arcazón o plomo rojo), son mixtos; es decir, resultan de la combinación de más de un óxido simple.
Pero la complejidad de los óxidos puede ir más allá. Existen mezclas o estructuras en las cuales pueden intervenir más de un metal, y donde además las proporciones no sean estequiométricas. En el caso del Pb3O4, la relación Pb/O es igual a 3/4, de la cual tanto el numerador como el denominador son números enteros.
En los óxidos no estequiométricos las proporciones son números decimales. El E0.75O1.78, es un ejemplo de un óxido hipotético no estequiométrico. Este fenómeno sucede con los denominados óxidos metálicos, en especial con los metales de transición (Fe, Au, Ti, Mn, Zn, etc.).
No obstante, existen óxidos cuyas características son mucho más simples y diferenciables, como lo es el carácter iónico o covalente. En aquellos óxidos donde predomine el carácter iónico, se compondrán de cationes E+ y aniones O2–; y aquellos puramente covalentes, los enlaces simples (E–O) o dobles (E=O).
Lo que dictamina el carácter iónico de un óxido es la diferencia de electronegatividad entre E y O. Cuando E es un metal muy electropositivo, entonces EO tendrá un alto carácter iónico. Mientras que si E es electronegativo, a saber, un no metal, su óxido EO será covalente.
Esta propiedad define muchas otras exhibidas por los óxidos, como lo es su capacidad de formar bases o ácidos en disolución acuosa. De aquí surgen los llamados óxidos básicos y ácidos. Los que no se comporten como ninguno de los dos, o que por el contrario manifiesten ambas características, son óxidos neutros o anfóteros.
Nomenclatura de los óxidos
Existen tres maneras de nombrar los óxidos (las cuales aplican también a muchos otros compuestos). Estas son correctas, sin importar el carácter iónico del óxido EO, por lo que sus nombres no dicen nada respecto a sus propiedades ni estructuras.
Nomenclatura sistemática
Dados los óxidos EO, E2O, E2O3 y EO2, a primera vista no puede conocerse qué hay detrás de sus fórmulas químicas. Sin embargo, los números indican las proporciones estequiométricas o la relación E/O. A partir de estos números se les puede dar nombres aunque no se especifique con qué valencia “trabaja” E.
Los números de átomos tanto para E como para O, se señalan con los prefijos de numeración griega. De esta manera, mono- quiere decir que hay un solo átomo; di-, dos átomos; tri-, tres átomos, y así sucesivamente.
Entonces, los nombres de los óxidos anteriores, de acuerdo a la nomenclatura sistemática, son:
–Monóxido de E (EO).
–Monóxido de diE (E2O).
–Trióxido de diE (E2O3).
–Dióxido de E (EO2).
Aplicando entonces esta nomenclatura para el Pb3O4, el óxido rojo de la primera imagen, se tiene:
Pb3O4: tetraóxido de triplomo.
Para muchos óxidos mixtos, o con proporciones estequiométricas elevadas, resulta de gran utilidad recurrir a la nomenclatura sistemática para nombrarlos.
Nomenclatura stock
Valencia
Aunque no se conozca qué elemento sea E, basta con la relación E/O para conocer qué valencia está utilizando en su óxido. ¿Cómo? Mediante el principio de electroneutralidad. Este exige que la suma de las cargas de los iones en un compuesto deba ser igual a cero.
Esto se hace asumiendo un carácter iónico alto para cualquier óxido. Así, el O tiene carga -2 por tratarse del O2-, y E debe aportar n+ de modo que neutralice las cargas negativas del anión óxido.
Por ejemplo, en el EO el átomo E trabaja con valencia +2. Pues de lo contrario no podría neutralizar la carga -2 del único O. Para el E2O, el E tiene valencia +1, ya que la carga +2 debe dividirse entre los dos átomos de E.
Y en el E2O3, deben calcularse primero las cargas negativas aportadas por el O. Como son tres de ellos, entonces: 3(-2)= -6. Para neutralizar la carga -6 se requiere que los E aporten +6, pero debido a que hay dos de ellos, +6 se divide entre dos, quedando E con valencia de +3.
Regla mnemotécnica
El O siempre tiene valencia -2 en los óxidos (a menos que se trate de un peróxido o superóxido). Por lo que una regla nemotécnica para determinar la valencia de E consiste simplemente en tomar en cuenta el número que acompaña al O. E, por su lado, tendrá el número 2 acompañándole, y de no ser así, significa que hubo una simplificación.
Por ejemplo, en EO la valencia de E es +1, porque aunque no se escriba, hay un solo O. Y para el EO2, al no haber un 2 acompañando a E, hubo una simplificación, y para que aparezca debe multiplicarse por 2. Así, la fórmula queda como E2O4 y la valencia de E es entonces +4.
Sin embargo, esta regla falla para algunos óxidos, como el Pb3O4. Por lo tanto, siempre es necesario realizar los cálculos de neutralidad.
En qué consiste
Una vez teniendo a mano la valencia de E, la nomenclatura stock consiste en especificarla dentro de unos paréntesis y con números romanos. De todas las nomenclaturas, esta es la más simple y precisa con respecto a las propiedades electrónicas de los óxidos.
Si E, por otro lado, tiene una sola valencia (la cual puede consultarse en la tabla periódica), entonces esta no se especifica.
Así, para el óxido EO si E tiene valencia +2 y +3, se llama: óxido de (nombre de E) (II). Pero si E solo tiene valencia +2, entonces su óxido se llama: óxido de (nombre de E).
Nomenclatura tradicional
Para mencionar el nombre de los óxidos debe añadirse a sus nombres en latín los sufijos –ico u –oso, para las valencias más grandes o pequeñas. En el caso de que haya más de dos, se recurre entonces a los prefijos –hipo, para la más pequeña, y –per, para la mayor de todas.
Por ejemplo, el plomo trabaja con valencias +2 y +4. En el PbO tiene valencia +2, de modo que se llama: óxido plumboso. Mientras que el PbO2 se llama: óxido plúmbico.
¿Y cómo se llama el Pb3O4, de acuerdo con las dos nomenclaturas anteriores? Carece de nombre, porque el Pb3O4 consiste realmente de una mezcla 2[PbO][PbO2]; es decir, el sólido rojo tiene doble concentración de PbO.
Por esta razón sería incorrecto intentar darle un nombre al Pb3O4 que no consista de la nomenclatura sistemática o del argot popular.
Tipos de óxidos
Dependiendo en qué parte de la tabla periódica se encuentre E y, por tanto, su naturaleza electrónica, se puede formar un tipo de óxido u otro. De aquí surgen múltiples criterios para asignarles un tipo, pero los más importantes son aquellos relacionados con su acidez o basicidad.
Óxidos básicos
Los óxidos básicos se caracterizan por ser iónicos, metálicos, y más importante, generar una solución básica al disolverse en el agua. Para determinar experimentalmente si un óxido es básico, debe agregarse a un recipiente con agua e indicador universal disuelto en ella. Su coloración antes de añadirle el óxido debe ser verde, pH neutro.
Una vez agregado el óxido al agua, si su color cambia de verde a azul, significa que el pH se tornó básico. Esto se debe a que establece un equilibrio de solubilidad entre el hidróxido formado y el agua:
EO(s) + H2O(l) => E(OH)2(s) => E2+(ac) + OH–(ac)
Aunque el óxido sea insoluble en el agua, basta con que una porción pequeña se disuelva para modificar el pH. Algunos óxidos básicos son tan solubles que generan hidróxidos cáusticos como el NaOH y KOH. Es decir, los óxidos de sodio y potasio, Na2O y K2O, son muy básicos. Nótese la valencia de +1 para ambos metales.
Óxidos ácidos
Los óxidos ácidos se caracterizan por tener un elemento no metálico, son covalentes, y además, generan soluciones ácidas con el agua. Nuevamente, puede comprobarse su acidez con el indicador universal. Si esta vez al añadir el óxido al agua, su color verde se torna rojizo, entonces se trata de un óxido ácido.
La reacción que toma lugar es la siguiente:
EO2(s) + H2O(l) => H2EO3(ac)
Un ejemplo de un óxido ácido, que no es un sólido sino un gas, es el CO2. Cuando este se disuelve en agua, forma el ácido carbónico:
CO2(g) + H2O(l) => H2CO3(ac)
Asimismo, el CO2 no consiste en aniones O2- y cationes C4+, sino en una molécula formada por enlaces covalentes: O=C=O. Esta es quizás una de las mayores diferencias entre los óxidos básicos y los ácidos.
Óxidos neutros
Estos óxidos no cambian el color verde del agua a pH neutro; es decir, no forman hidróxidos, ni ácidos en solución acuosa. Algunos de ellos son: N2O, NO y CO. Al igual que el CO, tienen enlaces covalentes que pueden ilustrarse por estructuras de Lewis o cualquier teoría del enlace.
Óxidos anfóteros
Otra forma de clasificar a los óxidos depende de si reaccionan o no con un ácido. El agua es un ácido muy débil (y una base también), por lo que los óxidos anfóteros no exhiben “sus dos caras”. Estos óxidos se caracterizan por reaccionar tanto con ácidos como con bases.
El óxido de aluminio, por ejemplo, es un óxido anfótero. Las siguientes dos ecuaciones químicas representan su reacción con ácidos o bases:
Al2O3(s) + 3H2SO4(ac) => Al2(SO4)3(ac) + 3H2O(l)
Al2O3(s) + 2NaOH(ac) + 3H2O(l) => 2NaAl(OH)4(ac)
El Al2(SO4)3 es la sal sulfato de aluminio, y el NaAl(OH)4 una sal compleja llamada tetrahidroxo aluminato de sodio.
El óxido de hidrógeno, H2O (el agua), también es anfotérico, y esto se evidencia en su equilibrio de ionización:
H2O(l) => H3O+(ac) + OH–(ac)
Óxidos mixtos
Los óxidos mixtos son aquellos que consisten de la mezcla de uno o más óxidos en un mismo sólido. El Pb3O4 es un ejemplo de ellos. La magnetita, Fe3O4, es también otro ejemplo de un óxido mixto. El Fe3O4 es una mezcla de FeO y Fe2O3 en proporciones 1:1 (a diferencia del Pb3O4).
Las mezclas pueden ser más complejas, originando así una variedad rica de minerales de óxidos.
Propiedades de los óxidos
Las propiedades de los óxidos dependen de su tipo. Los óxidos pueden ser iónicos (En+O2-), como el CaO (Ca2+O2–), o covalentes, como el SO2, O=S=O.
A partir de este hecho, y de la tendencia que tienen los elementos de reaccionar con ácidos o bases, se recolectan un número de propiedades para cada óxido.
Asimismo, lo anterior se refleja en las propiedades físicas como los puntos de fusión y ebullición. Los óxidos iónicos tienden a formar estructuras cristalinas muy resistentes al calor, por lo que sus puntos de fusión son elevados (superiores a los 1.000º C), mientras que los covalentes funden a bajas temperaturas, o incluso son gases o líquidos.
¿Cómo se forman los óxidos?
Los óxidos se forman cuando los elementos reaccionan con el oxígeno. Esta reacción puede ocurrir con el simple contacto con atmósferas ricas en oxígeno, o requiere de calor (como el de la llama de un mechero).
Es decir, al quemar un objeto este reacciona con el oxígeno (siempre y cuando esté presente en el aire).
Si se toma un pedazo de fósforo, por ejemplo, y se coloca en la llama, este arderá y formará el óxido correspondiente:
4P(s) + 5O2(g) => P4O10(s)
Durante este proceso algunos sólidos, como el calcio, pueden arder con una llama brillante y colorida.
Otro ejemplo se obtiene al quemar madera o cualquier sustancia orgánica, las cuales poseen carbono:
C(s) + O2(g) => CO2(g)
Pero si hay una insuficiencia de oxígeno se forma CO en lugar de CO2:
C(s) +1/2O2(g) => CO(g)
Nótese cómo la relación C/O sirve para describir óxidos distintos.
Ejemplos de óxidos
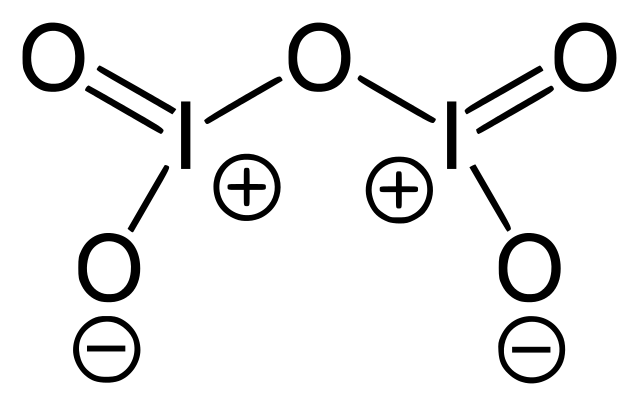
La imagen superior corresponde a la estructura del óxido covalente I2O5, el más estable que forma del yodo. Nótese sus enlaces simples y dobles, así como las cargas formales del I y de los oxígenos a sus laterales.
Los óxidos de los halógenos se caracterizan por ser covalentes y muy reactivos, como tal son los casos del O2F2 (F-O-O-F) y OF2 (F-O-F). El dióxido de cloro, ClO2, por ejemplo, es el único óxido de cloro que se sintetiza a escalas industriales.
Debido a que los halógenos forman óxidos covalentes, se calculan del mismo modo sus “hipotéticas” valencias a través del principio de la electroneutralidad.
Óxidos de metales de transición
Además de los óxidos de halógenos, se tiene a los óxidos de los metales de transición:
- CoO: óxido de cobalto (II); óxido cobaltoso; u monóxido de cobalto.
- HgO: óxido de mercurio (II); óxido mercúrico; u monóxido de mercurio.
- Ag2O: óxido de plata; óxido argéntico; o monóxido de diplata.
- Au2O3: óxido de oro (III); óxido áurico; o trióxido de dioro.
Ejemplos adicionales
- B2O3: óxido de boro; óxido bórico; o trióxido de diboro.
- Cl2O7: óxido de cloro (VII); óxido perclórico; heptóxido de dicloro.
- NO: óxido de nitrógeno (II); óxido nítrico; monóxido de nitrógeno.
Referencias
- Shiver & Atkins. (2008). Química Inorgánica. (cuarta edición). Mc Graw Hill.
- Metal and Nonmetal Oxides. Tomado de: chem.uiuc.edu
- Free Chemistry Online. (2018). Oxides and Ozone. Tomado de: freechemistryonline.com
- Toppr. (2018). Simple Oxides. Tomado de: toppr.com
- Steven S. Zumdahl. (07 de mayo de 2018). Oxide. Encyclopediae Britannica. Tomado de: britannica.com
- Chemistry LibreTexts. (24 de abril de 2018). Oxides. Tomado de: chem.libretexts.org
- Quimicas.net (2018). Ejemplos de Óxidos. Recuperado de:quimicas.net
