¿Cuál es el elemento más electronegativo y por qué?
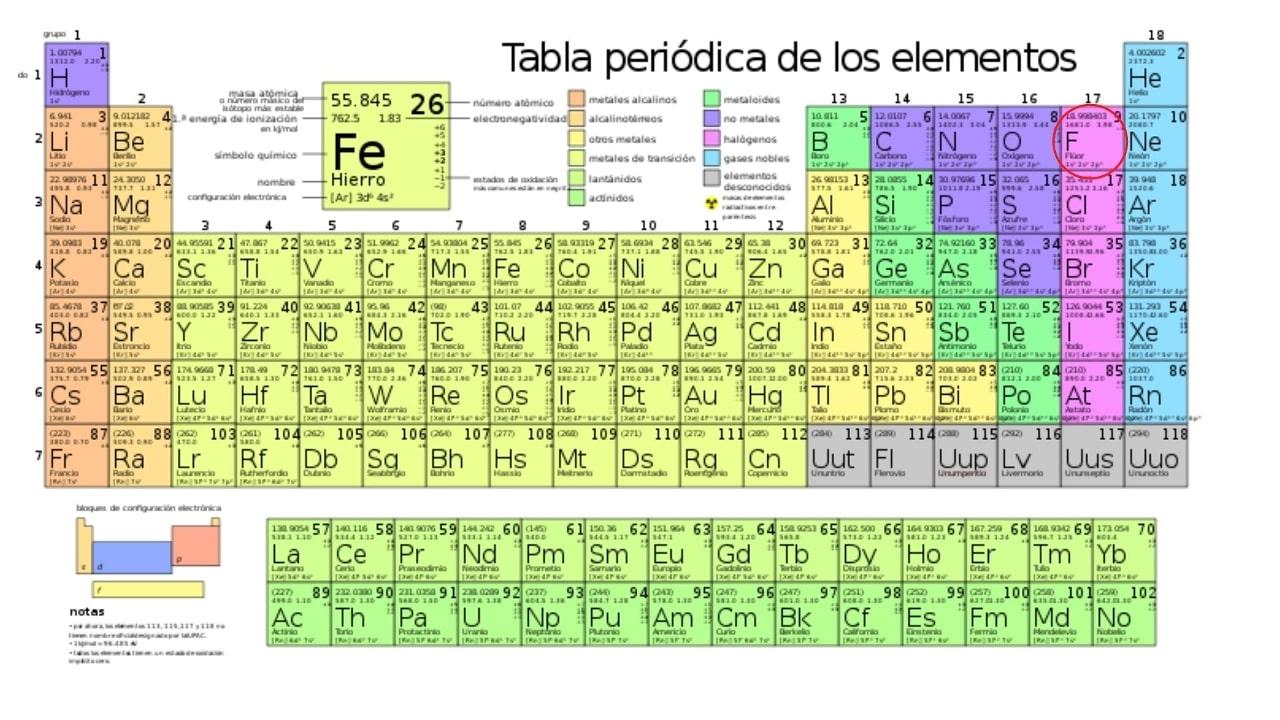
El elemento más electronegativo en la tabla periódica es el flúor, cuyo símbolo químico es F y pertenece al grupo de los halógenos. Entre todos los elementos de la tabla periódica, el flúor es el más ansioso por captar electrones de otros átomos.
Este elemento, gaseoso a temperatura ambiente, es altamente reactivo y por ello no es fácil hallarlo en estado puro en la naturaleza. El flúor enlaza fácilmente con otros elementos como azufre, calcio y metales, así como numerosos compuestos, sobre todo los que contienen hidrógeno.
Su elevada electronegatividad le permite incluso combinarse con gases nobles como xenón, kriptón y radón.
Después del flúor, el oxígeno es el segundo elemento con mayor electronegatividad. En contraste, los elementos con la menor electronegatividad son el francio (Fr) y el cesio (Cs).

Estos son, por tanto, los elementos más electropositivos que existen, si bien el francio es radiactivo y muy poco abundante en la naturaleza.
Electronegatividad y tabla periódica
La escala de la electronegatividad fue desarrollada por el químico y premio Nobel Linus Pauling (1901–1994), aunque el concepto se debe al químico sueco Jöns Jakob Berzelius (1779-1848).
La escala de Pauling, que asigna valores numéricos adimensionales a la electronegatividad, se utiliza para medir la intensidad con la que un átomo atrae al electrón de otro átomo distinto, y así formar enlaces.
Cada elemento tiene su propia electronegatividad, la cual depende de sus propiedades atómicas. Se determina experimentalmente y de forma indirecta, por ejemplo, midiendo la energía de enlace, tal como lo hizo Pauling hacia 1932.
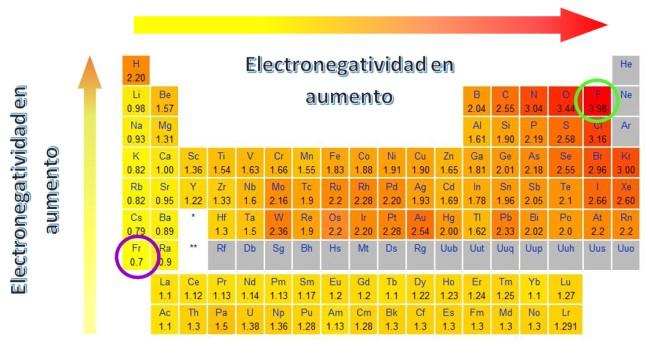
En la escala de electronegatividades de Pauling, el flúor está en primer lugar, con un valor aproximado de 3.98 ≈ 4.0.
La electronegatividad es una propiedad periódica de los elementos. En la mayor parte de los casos (hay algunas excepciones), se observa que la electronegatividad aumenta al desplazarse de izquierda a derecha por las filas de la tabla periódica.
Y asimismo, aumenta de abajo hacia arriba, al moverse sobre una columna.
La electronegatividad del flúor
La razón de que el flúor sea el elemento más electronegativo en la tabla periódica, se debe a su configuración electrónica (la forma en que sus electrones se disponen en orbitales alrededor del núcleo).
Dicha configuración es 1s22s22p5, por lo que el flúor tiene 5 electrones en su capa más externa.
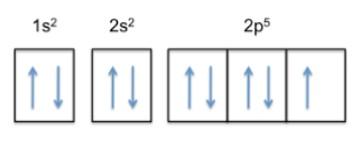
Ahora bien, como la tendencia del átomo es completar su capa externa, eso significa que el flúor aceptará un electrón de otros átomos con gran facilidad, a fin de ganar estabilidad y asemejarse al gas noble de la misma fila, que es el neón, cuya configuración electrónica es 1s22s22p6.
El átomo de flúor tiene un radio muy pequeño, dado que los protones en su núcleo atraen con mucha fuerza a los electrones, manteniéndolos más cerca que en los átomos de elementos menos electronegativos, como el cesio y el francio.
Por lo tanto, estos últimos están dispuestos a ceder electrones con facilidad para formar enlaces.
Referencias
- Aguilar, C. Guía para la Unidad de Aprendizaje Química I. Recuperado de: ipn.mx.
- Atkins, P. (2005). Principios de Química, los caminos del descubrimiento. 3ra. Edición. Editorial Médica Panamericana.
- Clark, J. Electronegativity. Recuperado de: chem.libretexts.org.
- Hein, M. (2014). Foundations of College Chemistry. 14th Ed. Wiley.
- Lenntech. Elementos químicos ordenados por su electronegatividad. Recuperado de: lenntech.es.
