Prometio (Pm): estructura, propiedades, obtención, usos
El prometio es un elemento químico que pertenece a la clase de los lantánidos. Se le identifica con el símbolo Pm y su número atómico es 61. Es un sólido metálico radioactivo y es el elemento más inestable de los primeros 84 elementos de la tabla periódica.
Este elemento se encuentra de forma natural en muy bajas concentraciones (cerca de 4 x 10-15 gramos por Kg) en un tipo de uraninita, que es un mineral de uranio, en el cual el prometio está presente debido a la fisión espontánea del uranio-238.

A pesar de su escasez en la corteza terrestre, ha sido detectado en el espectro de la estrella HR465 de la constelación Andrómeda, sobre cuya superficie se estima que se ha estado formando recientemente, pues ningún isótopo de Pm tiene una vida media más larga de 17,7 años.
Tuvo utilidad un tiempo en objetos que brillan en la oscuridad, pero debido a su radiactividad se dejó de usar en estos. Se emplea para medir espesores de materiales y en baterías de energía nuclear.
Índice del artículo
- 1 Descubrimiento
- 2 Estructura electrónica
- 3 Nomenclatura
- 4 Propiedades del prometio
- 5 Isótopos
- 6 Obtención actual
- 7 Usos
- 8 Riesgos
- 9 Referencias
La existencia del prometio fue sospechada en 1902 por el químico checo Bohuslav Brauner. Más tarde, en 1914, el físico inglés Henry Moseley halló en sus estudios que faltaba un elemento entre el neodimio y el samario.
Posteriormente, aunque varios grupos de investigadores (italianos en 1924, estadounidenses en 1926 y 1938) anunciaron su descubrimiento, la dificultad de separarlo de otros elementos y reproducir las experiencias hizo que ninguno pudiera llevarse el mérito.

Finalmente, en 1944 los investigadores Marinsky J.A., Glendenin L.E. y Coryell C.D. probaron su presencia y lo aislaron de los subproductos de la fisión de uranio en el reactor nuclear de los Laboratorios Clinton en Oak Ridge en Tennessee, Estados Unidos.

Sin embargo, no reclamaron la prioridad en el descubrimiento hasta 1946 por estar dedicados de lleno a investigaciones secretas relacionadas con actividades de defensa durante la Segunda Guerra Mundial.
Aunque los investigadores habían propuesto llamarlo “clintonium” en honor a los laboratorios donde trabajaban, la esposa de Coryell los convenció de llamarlo “prometio” como recuerdo del titán griego Prometeo o Prometheus.

Según algunas interpretaciones de la mitología griega, Prometheus robó fuego a los dioses para dárselo a la humanidad, por lo que fue cruelmente castigado por toda la eternidad. Otras leyendas dicen que proporcionó a los seres humanos las matemáticas, las ciencias, la agricultura y la medicina, e incluso que creó al hombre.

Estas dudas sobre cuál fue la contribución de Prometeo a la humanidad se asemeja a la incertidumbre acerca de quién descubrió el elemento. Por otro lado, según la esposa de Coryell, el nombre se justificaba pues los investigadores habían “robado el fuego de los dioses” al descubrirlo durante el programa secreto de la bomba atómica.
La configuración electrónica de este elemento es:
1s2; 2s2 2p6; 3s2 3p6 3d10; 4s2 4p6 4d10; 5s2 5p6; 4f5 6s2;
la cual también se puede expresar como:
[Xe] 4f5 6s2.
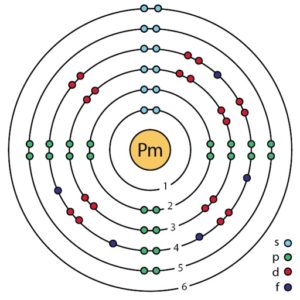
- Prometio, símbolo Pm.
- Prometio-147, Pm-147 o 147Pm: isótopo del prometio con masa atómica 147.
Sólido metálico de aspecto plateado, cristales hexagonales.
144,91
1042 ºC
3000 ºC
7,26 g/cm3
Pertenece a la familia de los lantánidos, lantanoides o “tierras raras”, llamados así debido a que en la corteza terrestre se hallan siempre en forma de sus óxidos. Forman parte del período 6 de la tabla periódica de los elementos.
Según fuentes consultadas, el Pm, como los demás lantánidos, reacciona directamente con el agua, lentamente en frío, rápidamente al calentar, liberando hidrógeno (H2). Se oscurece rápidamente en aire y se quema fácilmente produciendo su óxido.
Se han preparado más de 30 compuestos de prometio y la mayoría presenta algún tipo de coloración. Su estado de oxidación en estos compuestos es de +3. No forma cationes tetravalentes.
Disolviéndolo en ácido clorhídrico (HCl) el prometio forma el PmCl3 el cual es amarillo y soluble en agua. En ácido nítrico (HNO3) se genera el Pm(NO3)3 que es de color rosado y también soluble en agua.
Si una solución que contiene iones Pm3+ se alcaliniza con NH3, es decir, se aumenta el pH, precipita el hidróxido (Pm(OH)3) de color marrón claro.
El sulfato Pm2(SO4)3 es ligeramente soluble en agua. Si se calienta el oxalato de prometio se convierte en el óxido Pm2O3 de color blanco o lavanda.
Emite radiación beta en forma de electrones que salen del núcleo de sus átomos. Al emitirla se convierte en el elemento samario (Sm). Por otra parte, se puede convertir en neodimio (Nd) mediante la eliminación de un positrón del núcleo y la captura de un electrón en el mismo. El Pm no emite rayos gamma.
Hasta ahora se conocen 14 isótopos de prometio, con masas atómicas que van desde 134 hasta 155. Todos son inestables (radiactivos), lo cual lo diferencia de los demás lantánidos.
El prometio-147 es el que tiene una mayor utilidad y tiene una vida media de 2,6 años.
El isótopo con vida media más larga es el prometio-145 con 17,7 años, el cual decae mediante captura electrónica, que consiste en que un electrón atómico se combina con un protón y forma un neutrón y un neutrino.
Sin embargo, es el único isótopo de Pm que también puede sufrir desintegración alfa (emisión de 2 neutrones). Esto se debe a que tiene 84 neutrones y la emisión de 2 de ellos lo convierte en prometio-141 con 82 neutrones, que es una configuración estable del núcleo. Pero este es un tipo de decaimiento que ocurre muy poco.
En 1963 se prepararon cerca de 10 gramos de prometio utilizando métodos de cromatografía de intercambio iónico en desechos de combustible de reactor atómico. Hoy en día aún se recupera de esta forma como sales de 147Pm3+.
Según ciertas fuentes también se preparó en esos años a través de la reducción del fluoruro (PmF3) con vapor de litio (Li). Corrientemente también se prepara por la reducción del cloruro (PmCl3) con calcio (Ca) a altas temperaturas.
Además se puede obtener a partir del neodimio-146. Se somete este isótopo a bombardeo con neutrones para que cada átomo capture un neutrón y se convierta en neodimio-147. Este último tarda unos 11 días sufriendo desintegración beta transformándose así en prometio-147.
El isótopo 147 (147Pm) es el que más se ha empleado, siendo el único que se puede encontrar de forma comercial. No emite rayos gamma y se suministra en forma del óxido o el cloruro. Sin embargo, su transporte y manipulación requieren protección contra las radiaciones.
Poseía algunos usos que hoy en día ya no tiene, pues actualmente solo se utiliza en aplicaciones especiales.
El prometio-147 se emplea en baterías atómicas de larga duración. En este caso se colocan pequeñas piezas del Pm en la matriz de un semiconductor para convertir las emisiones beta en electricidad.
Este tipo de baterías de energía nuclear puede proporcionar energía durante unos 5 años y han sido usadas en todo tipo de dispositivos, desde misiles hasta marcapasos, los cuales son dispositivos colocados en pacientes con problemas cardíacos.

Según ciertas fuentes el óxido de prometio es empleado en medicina como fuente de radiación.
Se ha usado para medir el espesor de algunos materiales, lo que se realiza midiendo la radiación beta que pasa a través de las muestras.
Se podría utilizar como fuente transportable de rayos X, pero aparentemente esta aplicación aún no ha sido desarrollada comercialmente.
También serviría para proporcionar energía a las sondas espaciales y satélites o para hacer dispositivos que permitan la comunicación con submarinos.
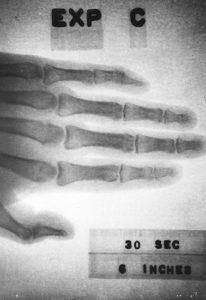
Inicialmente el prometio-147 se usó para reemplazar el elemento radio en los diales luminosos, pues se supo que el radio era demasiado peligroso. Para ello se mezclaba el PmCl3 con luminóforos, los cuales brillan de amarillo verdoso a azul cuando la radiación del prometio (partículas beta) los impacta.

Esta propiedad se utilizaba en relojes de pulsera o en los diales para que brillaran en la oscuridad. También en el botón de encendido de algunas lámparas fluorescentes. Además, no dañaba los luminóforos como ocurre con otras fuentes de radiación beta, extendiendo la vida de los dispositivos.
Sin embargo, cuando se descubrió que el prometio también es peligroso se paró su uso en el mercado de los objetos que brillan en la oscuridad.
El Pm es un elemento radioactivo, por lo que debe manipularse con extrema precaución y con la protección debida. Además de las partículas beta que emite, estas pueden impactar elementos con un número atómico mayor y generar rayos X.

- U.S. National Library of Medicine. (2019). Promethium – Pm (Element). Recuperado de pubchem.ncbi.nlm.nih.gov.
- Ganjali, M.R. et al. (2016). Introduction to Lanthanide Series (From Lanthanum to Lutetium). Promethium. In Lanthanides Series Determination by Various Analytical Methods. Recuperado de sciencedirect.com.
- Choppin, G. et al. (2013). The Origin of the Universe and Nucleosynthesis. Slow neutron capture. In Radiochemistry and Nuclear Chemistry (Fourth Edition). Recuperado de sciencedirect.com.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Royal Society of Chemistry. (2020). Promethium. Recuperado de rsc.org.
