Isopentano: estructura, propiedades, usos, obtención
El isopentano es un compuesto orgánico cuya fórmula condensada es (CH3)2CHCH2CH3. Se trata de un alcano, específicamente de un isómero ramificado del pentano, caracterizado por ser un líquido altamente volátil y que utiliza como agente espumante. Actualmente, su nombre más recomendado por la IUPAC es el 2-metilbutano.
En la imagen inferior se aprecia su fórmula estructural. Nótese que un grupo CH3 efectivamente se encuentra enlazado al carbono 2 de la cadena butílica. Del isopentano se obtiene el sustituyente o radical isopentil o isopentilo, siendo uno de los sustituyentes alquílicos más voluminosos que pueda haber.
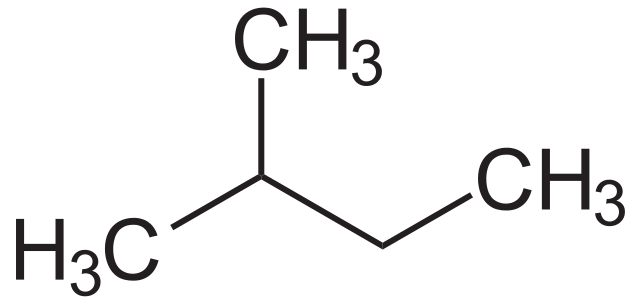
El isopentano es un compuesto apolar, hidrofóbico e inflamable. Su olor es parecido al de la gasolina, y forma parte de hecho de su composición, pues incrementa su número de octano u octanaje. Se obtiene a partir de la reacción de isomerización del n-pentano, aunque naturalmente se consigue en escasas cantidades dentro de las reservas de gas natural.
Dejando a un lado su carácter altamente inflamable, el isopentano se considera una sustancia no tóxica. Una persona puede ingerirla y olerla con moderación antes de que presente síntomas indeseables, como ganas de vomitar y mareos. El isopentano puede encontrarse en cremas de afeitar y en acondicionadores de cabello.
Índice del artículo
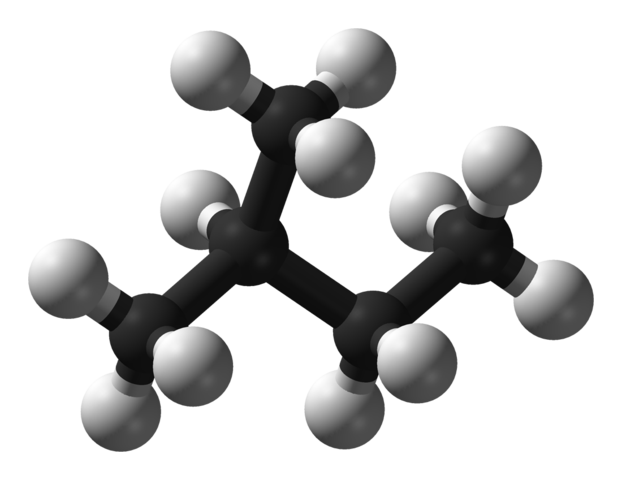
En la imagen superior tenemos la estructura molecular del isopentano, representada por un modelo de esferas y barras. Las esferas negras corresponden a los átomos de carbono, mientras las esferas blancas a los átomo de hidrógeno. De su esqueleto carbonado puede decirse que es robusto, ramificado y voluminoso.
Los extremos de la molécula de isopentano vienen comprendidos por grupos CH3, los cuales son ineficientes cuando se trata de reforzar las interacciones intermoleculares. Las moléculas de isopentano dependen de las fuerzas dispersivas de London y de sus masas para poder mantenerse cohesionadas, y definir así un líquido en condiciones normales de temperatura y presión.
No obstante, su geometría y los grupos CH3 son responsables de que el líquido de isopentano sea altamente volátil y hierva a una temperatura de 28.2 ºC. Por ejemplo, el isómero lineal n-pentano hierve alrededor de los 36 ºC, lo cual es reflejo de sus mejores interacciones intermoleculares.
A pesar de su aparente robustez, la molécula de isopentano es capaz de adoptar varias configuraciones espaciales, factor clave en el establecimiento de su cristal a una temperatura de -160 ºC.
Líquido o gas incoloro, con un aspecto acuoso, y que desprende además un olor parecido al de la gasolina. Es una sustancia altamente volátil.
El isopentano cristaliza a un intervalo de temperatura entre -161 y -159 ºC.
El isopentano hierve a un intervalo de temperatura entre 27.8 y 28.2 ºC. Por lo tanto, apenas se exponga fuera de su recipiente comenzará a hervir y a desprender grandes volúmenes de vapor.
76.9 kPa a 20 ºC (cerca de 0.76 atm)
0.6201 g/mL a 20 ºC. Los vapores de isopentano son 2.48 más densos que el aire.
El isopentano por ser una sustancia apolar, es insoluble e inmiscible con el agua y algunos alcoholes. Es soluble y miscible en solventes parafínicos, éteres, tetracloruro de carbono, y también en líquidos aromáticos como el tolueno.
1.354
15 dyn/cm a 20 ºC
0.214 cP a 20 ºC
-51 ºC. Esta temperatura convierte al isopentano en una sustancia peligrosamente inflamable, por lo que sus productos deben mantenerse lo más alejados posible de cualquier llama o fuente de calor.
420 ºC

El isopentano es un solvente orgánico que sirve como medio de reacción para ciertas síntesis orgánicas, y también representa la materia prima para la producción de otros compuestos.
Se agrega a la gasolina para incrementar su octanaje, y a varios productos cosméticos para mejorar su textura, como las cremas de afeitar, una vez se evapora rápidamente y deja atrás una masa burbujeante.
Similarmente, el poliestireno se humedece en isopentano para que, al evaporarse, expanda el plástico hasta crear una especie de espuma, con la cual se diseñan vasos, maquetas, platos, bandejas, etc.
Por otro lado, en la criogenia se utiliza el isopentano, junto con el hielo seco y el nitrógeno líquido, para congelar tejidos y muestras biológicas.
El isopentano puede obtenerse a partir de los reservorios de gas natural, ocupando sin embargo apenas el 1% de su contenido.
Otra vía, la más utilizada a nivel industrial, es partiendo del n-pentano destilado de los procesos de refinación del petróleo. Luego, el n-pentano se somete a una reacción especial llamada isomerización.
El propósito de la isomerización del n-pentano es obtener sus isómeros más ramificados. Así, entre los productos no solo tenemos al isopentano sino también al neopentano. Esta reacción es posible mediante el empleo de catalizadores metálicos muy específicos, los cuales controlan qué temperatura y qué presiones son requeridas.
El isopentano se considera una sustancia no tóxica. Esto se debe en parte a su baja reactividad, pues sus enlaces C-C o C-H no son fáciles de romper, por lo que no interfieren como tal en ningún proceso metabólico. De hecho, una persona es capaz de inhalar altas cantidades de sus vapores antes de sufrir de asfixia, sin que aparentemente sufra de daños colaterales.
Su ingesta provoca nauseas y vómitos, y su contacto con la piel termina resecándola. Por otro lado, estudios médicos no han podido concretar si el isopentano es una sustancia cancerígena. No obstante, se le considera como un contaminante peligroso para los ecosistemas marinos y su fauna.
El mayor peligro entorno al isopentano no es tanto su reactividad, sino su inflamabilidad: arde con el oxígeno del aire. Y debido a que su líquido es altamente volátil, la más mínima fuga desprenderá hacia el ambiente muchos de sus vapores, los cuales se encenderán a la menor cercanía de una llama o cualquier otra fuente de calor.
Es por eso que los productos que contienen isopentano deben almacenarse en ambientes seguros y frescos.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Isopentane. Recuperado de: en.wikipedia.org
- National Center for Biotechnology Information. (2020). Isopentane. PubChem Database. CID=6556. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Isopentane. ScienceDirect. Recuperado de: sciencedirect.com
- Jennifer B. Galvin & Fred Marashi. (2010). 2-Methylbutane (Isopentane). Journal of Toxicology and Environmental Health, Part A Current Issues. Volume 58, 1999 – Issue 1-2. doi.org/10.1080/009841099157403
