Anión: formación, características y tipos
Un anión es toda especie química con carga negativa, además de ser uno de los dos tipos de iones existentes. Su carga negativa se origina del hecho de que presenta un exceso de electrones en comparación a la forma neutra de la especie; por cada electrón adicional, su carga negativa aumenta en una unidad.
La carga negativa puede hallarse localizada en uno o más átomos, así como abarcar su influencia a una molécula en su totalidad. A modo de simplificación, independientemente de dónde esté la carga (-), se le considera un anión a toda la especie, compuesto o molécula.
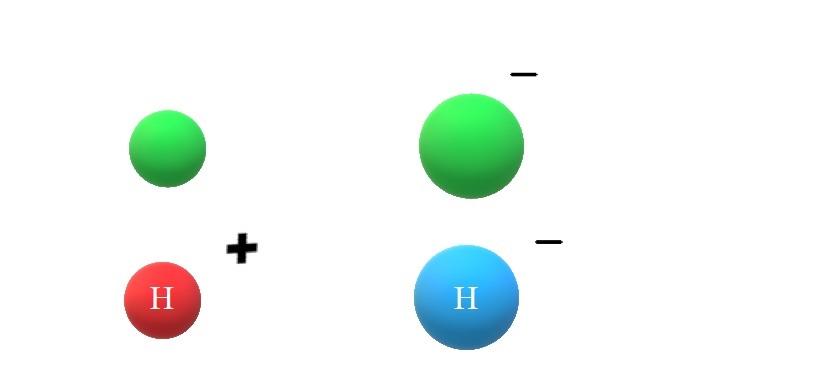
Si una especie neutra X gana un electrón, el exceso de cargas negativas se manifestará en la formación del anión X–, lo cual también acarreará el incremento de su radio atómico (imagen superior, con esferas verdes). X y X– difieren enormemente en sus propiedades y en el modo en como interaccionan con su entorno.
Si se supone ahora que X es el átomo de H, por ejemplo, de él puede surgir un catión o anión: H+ o H–, respectivamente. El catión H+ es el ion hidrógeno, llamado también protón; y el H– es el anión hidruro, el más “simple” de todos los aniones conocidos.
Índice del artículo
La formación de un anión puede explicarse con facilidad dentro de la teoría; aunque, experimentalmente, puede llegar a ser un desafío, en especial si se le quiere puro, sin cargas positivas atraídas por sus cargas negativas.
Un anión se formará cuando haya un exceso o ganancia de electrones en un átomo. Dicha ganancia puede determinarse haciendo uso de las cargas formales en una estructura de Lewis. Asimismo, mediante el método anterior se puede saber exactamente de qué átomo o grupo de ellos proviene la carga negativa.
Cuando los átomos forman enlaces covalentes, aunque la repartición de los electrones sea equitativa, puede haber una pérdida parcial de electrones. En este sentido, mientras menos enlaces formen los átomos más electronegativos, más pares libres de electrones tendrán y exhibirán por ende cargas negativas.
Considere por ejemplo la molécula de amoníaco, NH3. El NH3 es neutro y por tanto no tiene cargas eléctricas. Si se le quitara un H, es decir, se rompiera un enlace N-H, se obtendría el anión NH2–. Dibujando su estructura de Lewis y calculando la carga formal del N se podrá comprobar esto.
Siguiendo en la ruptura de más enlaces N-H, ahora se tiene el anión NH2-; y eliminando el último H, se obtiene finalmente el anión N3-, llamado anión nitruro. El nitrógeno ya no tiene cómo ganar más electrones, y su carga -3 es la más negativa que puede alcanzar; sus orbitales no dan para más.
Un anión puede formarse producto de una reducción: gana electrones oxidando a otra especie, la cual los pierde. El oxígeno, por ejemplo, representa muy bien este tipo de reacción química.
Cuando el oxígeno se reduce, oxida a otra especie, y pasa a transformarse en el anión óxido, O2-; presente en innumerables minerales y compuestos inorgánicos.
Un átomo puede ganar electrones si está en fase gaseosa:
X(g) + e– => X–(g)
Esta manera de formarse un anión implica un amplio conocimiento de técnicas físicas, a la vez que los aniones gaseosos no son fáciles de estudiar, ni todas las especies son volatilizadas o atomizadas con sencillez a la fase gaseosa.
En términos generales se mencionarán abajo las características típicas de un anión antes de abordar sus tipos y ejemplos:
-Es más voluminoso que el átomo neutro del que deriva.
-Puede ser más o menos estable, a pesar de la creciente repulsión electrónica entre sus propios electrones.
-Si el anión proviene de un átomo poco electronegativo, como el carbono, es muy reactivo.
-Establece momentos dipolares fuertes.
-Aumenta aún más su interacción con solventes polares.
-El anión monoatómico es isoelectrónico al gas noble de su período; esto es, tiene en su capa de valencia el mismo número de electrones.
-Puede polarizar la nube electrónica de un átomo vecino, repeliendo sus electrones externos.
Como su nombre indica, es un anión que consiste de un solo átomo: la carga negativa está bien localizada. Cada grupo de la tabla periódica tiene cargas negativas características; y por tratarse de aniones, son los no metales ubicados en el bloque p. Algunos ejemplos y sus nombres son a continuación:
-Cl–, cloruro.
-I–, yoduro.
-F–, fluoruro.
-Br–, bromuro.
-O2-, óxido.
-S2-, sulfuro.
-Se2-, seleniuro.
-Te2-, telururo.
-Po2-, poloniuro.
-N3-, nitruro.
-P3-, fosfuro.
-As3-, arseniuro.
-Sb3-, antimoniuro.
-C4-, carburo.
-Si4-, siliciuro.
-B3-, boruro.
Los oxoaniones se caracterizan por tener un enlace X=O, donde X puede ser cualquier elemento no metálico (excepto el flúor), o un metal (cromo, manganeso, ect.). También pueden tener uno o varios enlaces simples X-O.
Algunos oxoaniones con sus respectivos nombres son:
-ClO–, hipoclorito.
-BrO–, hipobromito.
-IO–, hipoyodito.
-ClO2–, clorito.
-ClO3–, clorato.
-IO3–, yodato.
-ClO4–, perclorato.
-PO43-, fosfato.
-CO32-, carbonato.
-CrO42-, cromato.
-Cr2O72-, dicromato.
-SO42-, sulfato.
-S2O32-, tiosulfato.
-NO3–, nitrato.
-NO2–, nitrito.
-BO33-, borato.
-AsO43-, arseniato.
-PO33-, fosfito.
-MnO4–, permanganato.
Las moléculas orgánicas tienen grupos funcionales que pueden cargarse eléctricamente. ¿Cómo? Mediante la formación o ruptura de enlaces covalentes, muy similar al ejemplo de la molécula de NH3.
Algunos aniones orgánicos son:
-CH3COO–, acetato.
-HCOO–, formato.
-C2O42-, oxalato.
-RCOO–, carboxilato.
-CH3CONH–, amidato.
-RO–, alcóxido.
-R3C–, carbanión.
-CH3O–, metóxido.
Los oxoaniones también son aniones poliatómicos, es decir, constan de más de un átomo. Lo mismo sucede con los aniones orgánicos. Sin embargo, los poliatómicos no entran en ninguna de las clasificaciones anteriores. Algunos de ellos son:
-CN–, cianuro (tiene un triple enlace, C≡N).
-OCN–, cianato.
-SCN–, tiocianato.
-NH2–, Amiduro.
-OH–, hidroxilo, hidróxido u oxidrilo.
-O2–, superóxido.
-O22-, peróxido.
En los aniones orgánicos se mencionaron algunos grupos funcionales cargados negativamente. Estos grupos pueden formar parte de una molécula grande, y así el anión puede tratarse de todo un compuesto robusto y de muchos enlaces. El más simple de este tipo de aniones es la hipotética molécula de H2–.
Entre otro ejemplo de estos aniones están los polisulfuros, Sn2-, los cuales consisten de cadenas con múltiples enlaces S-S. Asimismo, puede contarse los compuestos de coordinación de metales con carga negativa, como el [CoCl4(NH3)2]− y [CuCl4]2-.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Wikipedia. (2019). Anión. Recuperado de: es.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (21 de marzo de 2019). Common Anions Table and Formulas List. Recuperado de: thoughtco.com
- CK-12 Foundation. (29 de junio de 2016). Anion formation. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Francis E. (2002). Anions. Clackamas Community College. Recuperado de: dl.clackamas.edu
- American Physical Society. (03 de noviembre de 2011). Synopsis: The Simplest Molecular Anion. Recuperado de: physics.aps.org
