Electrón diferencial: concepto, números cuánticos, ejemplos
El electrón diferencial o diferenciador es el último electrón colocado en la secuencia de la configuración electrónica de un átomo. ¿A qué se debe su nombre? Para responder a esta pregunta es necesario conocer la estructura básica de un átomo: su núcleo, el vacío y los electrones.
El núcleo es un agregado denso y compacto de partículas positivas llamadas protones, y de partículas neutras llamadas neutrones. Los protones definen el número atómico Z y, junto a los neutrones, conforman la masa atómica. Sin embargo, un átomo no puede portar solo cargas positivas; por ello los electrones orbitan alrededor del núcleo para neutralizarlo.

Así, por cada protón que se sume al núcleo, un nuevo electrón se incorpora a sus orbitales para contrarrestar la creciente carga positiva. De este modo, el nuevo electrón añadido, el electrón diferencial, está estrechamente relacionado con el número atómico Z.
El electrón diferencial se encuentra en la capa electrónica más externa: la capa de valencia. Por lo tanto, mientras más alejado se encuentre del núcleo, mayor es la energía asociada a él. Es esta energía la responsable de su participación, así como la del resto de los electrones de valencia, en las reacciones químicas características de los elementos.
Índice del artículo
- 1 Números cuánticos
- 2 ¿Cómo conocer el electrón diferencial?
- 3 Ejemplos de electrones diferenciales en varios elementos
- 4 Referencias
Así como el resto de los electrones, el electrón diferencial puede ser identificado por sus cuatro números cuánticos. Pero, ¿cuáles son los números cuánticos? Ellos son “n”, “l”, “m” y “s”.
El número cuántico “n” denota el tamaño del átomo y los niveles de energía (K, L, M, N, O, P, Q). “l” es el número cuántico secundario o acimutal, el cual indica la forma de los orbitales atómicos, y toma valores de 0, 1, 2 y 3 para los orbitales “s”, “p”, “d” y “f”, respectivamente.
“m” es el número cuántico magnético e indica la orientación espacial de los orbitales bajo un campo magnético. Así, 0 para el orbital “s”; -1, 0, +1, para el orbital “p”; -2, -1, 0, +1, +2, para el orbital “d”; y -3, -2, -1, 0, +1, +2, +3, para el orbital “f”. Por último, el número cuántico de espín “s” (+1/2 para ↑, y -1/2 para ↓).
Por lo tanto, un electrón diferencial tiene asociado los anteriores números cuánticos (“n”, “l”, “m”, “s”). Debido a que contrarresta la nueva carga positiva generada por el protón adicional, proporciona asimismo el número atómico Z del elemento.
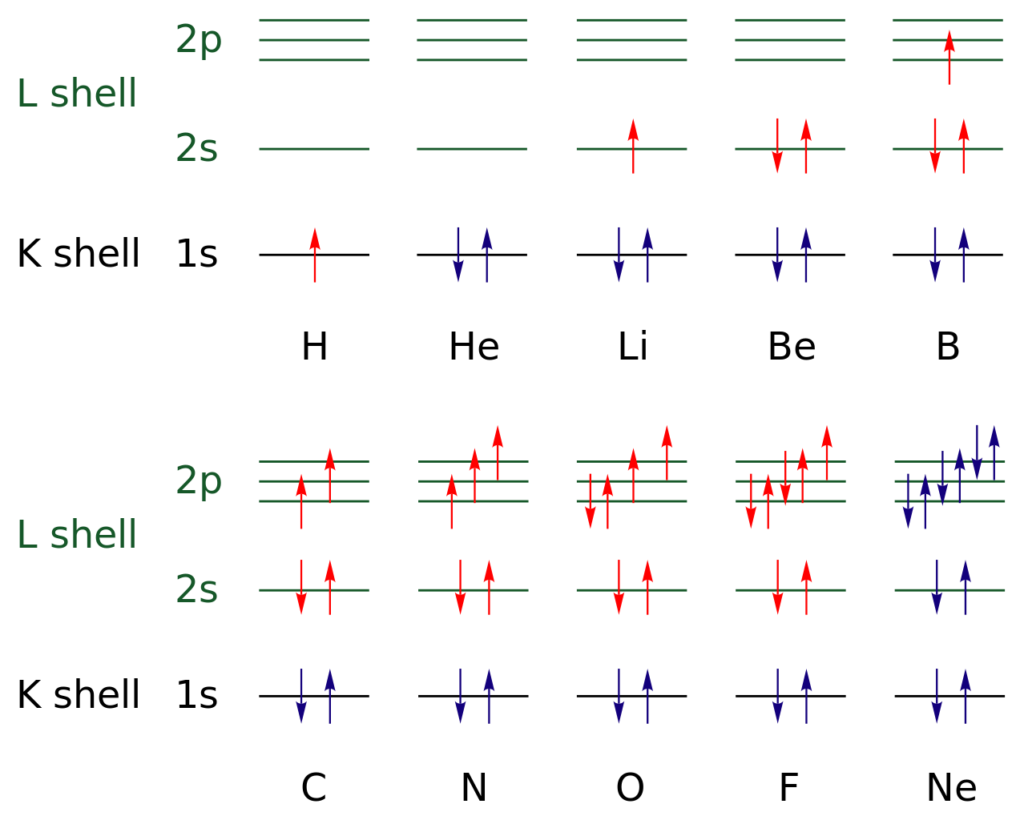
En la imagen superior se representan las configuraciones electrónicas para los elementos desde el hidrógeno hasta el gas neón (H → Ne).
En esta, los electrones de las capas abiertas están indicados con el color rojo, mientras que los de las capas cerradas se indican con el color azul. Las capas hacen referencia al número cuántico “n”, el primero de los cuatro.
De este modo, la configuración de valencia del H (↑ de color rojo) añade otro electrón con orientación opuesta para convertirse en la del He (↓↑, ambas azules porque ahora el nivel 1 está cerrado). Este electrón añadido es entonces el electrón diferencial.
Así, gráficamente puede observarse cómo el electrón diferencial se suma a la capa de valencia (flechas rojas) de los elementos, diferenciándolos unos de otros. Los electrones llenan los orbitales respetando la regla de Hund y el principio de exclusión de Pauling (perfectamente observado desde el B hasta el Ne).
¿Y qué hay de los números cuánticos? Estos definen cada flecha —es decir, cada electrón— y sus valores pueden corroborarse con la configuración electrónica para saber si son o no los del electrón diferencial.
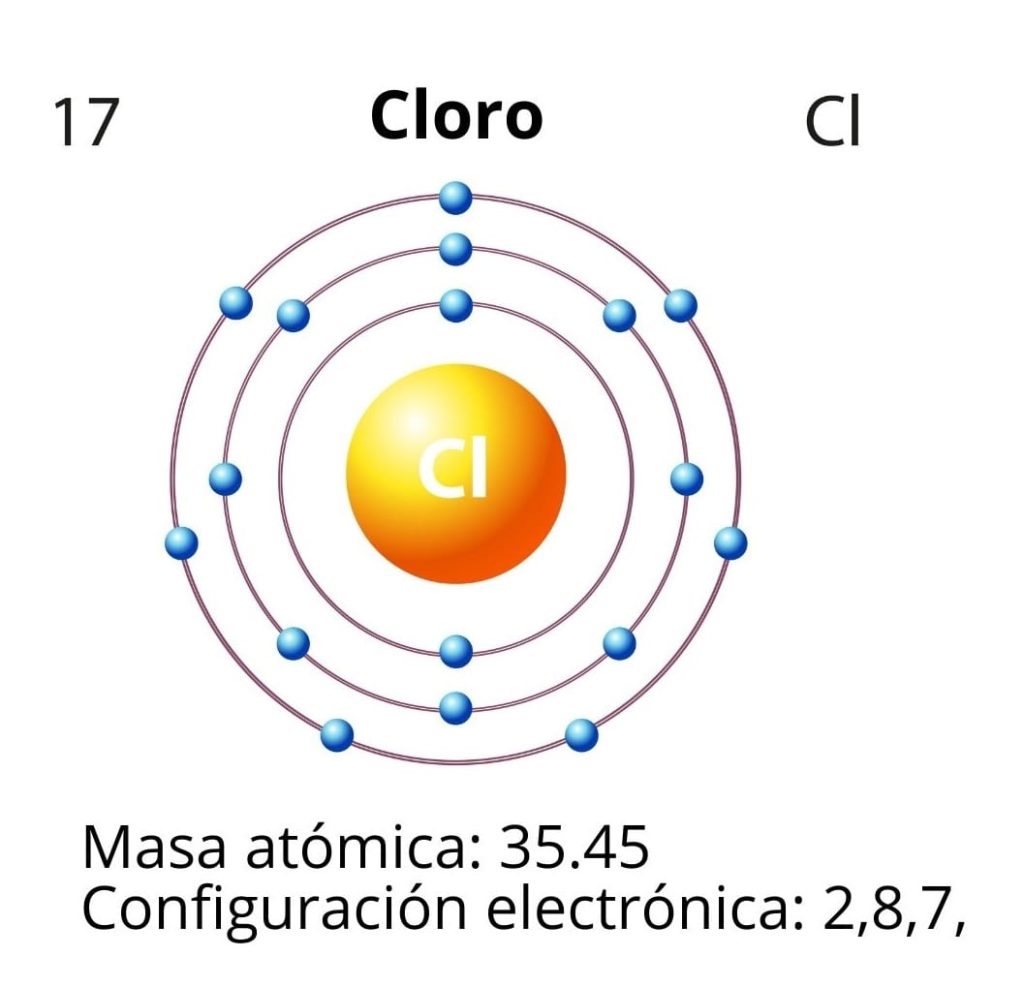
Para el caso del cloro (Cl) su número atómico Z es igual a 17. La configuración electrónica es entonces 1s22s2sp63s23p5. Los orbitales marcados en rojo corresponden a los de la capa de valencia, la cual presenta el nivel 3 abierto.
El electrón diferencial es el último electrón que se coloca en la configuración electrónica, y el átomo de cloro es aquel del orbital 3p, cuya disposición es la siguiente:
↑↓ ↑↓ ↑_
3px 3py 3pz
(-1) (0) (+1)
Respetando la regla de Hund, primero se llenan los orbitales 3p de igual energía (una flecha hacia arriba en cada orbital). Segundo, los otros electrones se aparean con los electrones solitarios de izquierda a derecha. El electrón diferencial se representa en un marco verde.
Así, el electrón diferencial para el cloro tiene los siguientes números cuánticos: (3, 1, 0, -1/2). Es decir, “n” es 3; “l” es 1, orbital “p”; “m” es 0, porque es el orbital “p” del medio; y “s” es -1/2, ya que la flecha apunta hacia abajo.
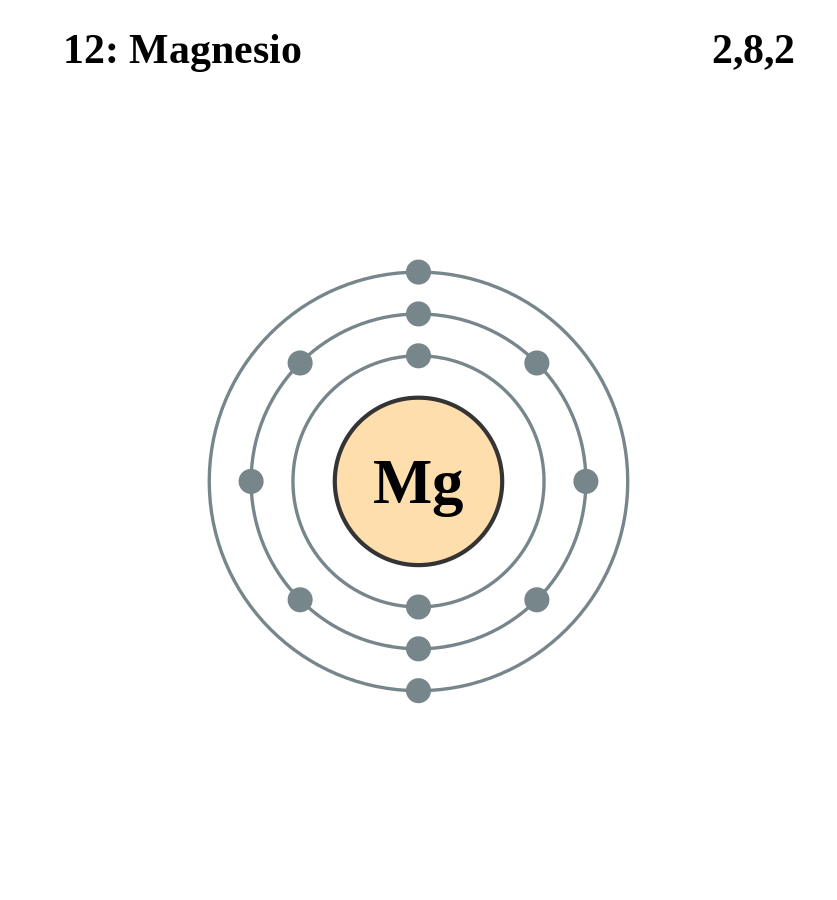
La configuración electrónica para el átomo de magnesio es 1s22s2sp63s2, representando el orbital y su electrón de valencia del mismo modo:
↑↓
3s
0
Esta vez, el electrón diferencial tiene los números cuánticos 3, 0, 0, -1/2. La única diferencia en este caso respecto al del cloro es que el número cuántico “l” es 0 debido a que el electrón ocupa un orbital “s” (el 3s).
La configuración electrónica para el átomo de zirconio (metal de transición) es 1s22s2sp63s23p64s23d104p65s24d2. Del mismo modo que los casos anteriores, la representación de los orbitales y electrones de valencia es como sigue:

Así, los números cuánticos para el electrón diferencial marcado en verde son: 4, 2, -1, +1/2. Aquí, como el electrón ocupa el segundo orbital “d”, tiene por número cuántico “m” igual a -1. Asimismo, debido a que la flecha apunta hacia arriba, su número de espín “s” es igual a +1/2.
Los números cuánticos del electrón diferencial para un elemento desconocido son 3, 2, +2, -1/2. ¿Cuál es el número atómico Z del elemento? Conociendo Z se puede descifrar cuál es el elemento.
Esta vez, como “n” es igual 3, significa que el elemento está en el tercer período de la tabla periódica, con orbitales “d” como capa valencia (“l” igual a 2). Por lo tanto, se representan los orbitales como en el ejemplo anterior:
↑↓↑↓↑↓↑↓↑↓
Los números cuánticos “m” igual a +2, y “s” igual a -1/2, son claves para ubicar correctamente al electrón diferencial en el último orbital 3d.
Así, el elemento que se busca tiene los orbitales 3d10 llenos, al igual que sus capas electrónicas internas. En conclusión, el elemento es el metal cinc (Zn).
Sin embargo, los números cuánticos del electrón diferencial no pueden discernir entre el cinc y el cobre, debido a que este último elemento también presenta orbitales 3d llenos. ¿Por qué? Porque el cobre es un metal que incumple con las reglas de llenados de los electrones por motivos cuánticos.
- Jim Branson. (2013). Hund’s Rules. Recuperado de quantummechanics.ucsd.edu
- Lecture 27: Hund’s rules. Recuperado de ph.qmul.ac.uk
- Purdue University. Quantum Numbers and Electron Configurations. Recuperado de chemed.chem.purdue.edu
- Enciclopedia Salvat de las ciencias. (1968). Física Salvat, S.A. de Ediciones Pamplona, tomo 12, España, pág 314-322.
- Walter J. Moore. (1963). Physical Chemistry. In particles and waves. Fourth edition, Longmans.
