Alanina: características, estructura, funciones, biosíntesis
La alanina (Ala) es uno de los 22 aminoácidos conocidos que conforman la estructura de las proteínas de todos los organismos, desde las bacterias hasta los hombres. Como el organismo lo puede sintetizar, este se clasifica como un aminoácido no esencial.
Las proteínas tienen una estructura básica o primaria conformada por una cadena de aminoácidos llamada cadena polipeptídica, en esas cadenas cada aminoácido está formado por un carbono central llamado carbono α.
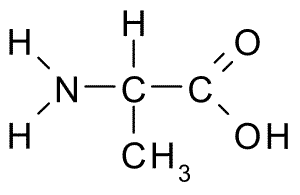
El carbono α se une a cuatro grupos: un grupo amino (—NH2), un grupo carboxilo (—COOH), un átomo de hidrógeno (—H) y un grupo o cadena lateral (—R) que identifica a cada aminoácido. En la cadena lateral, los carbonos toman secuencialmente las letras ß, γ, δ y ε.
Los aminoácidos se clasifican por la polaridad de sus cadenas laterales y así existen aminoácidos apolares hidrofóbicos y polares hidrofílicos que, a su vez, pueden ser neutros, básicos y ácidos. La alanina es un aminoácido apolar hidrofóbico y es el aminoácido más sencillo después de la glicina y el más abundante en la mayoría de las proteínas.
La alanina puede formarse en el músculo y transportarse al hígado, donde es introducido a la ruta gluconeogénica, es decir, la ruta para la formación de glucosa a partir de sustancias no glucosídicas. La alanina puede sintetizarse también en el hígado a través del catabolismo del triptófano y del uracilo y puede degradarse para formar piruvato.
Participa en la síntesis de triptófano, de la piridoxina (Vitamina B6) y de la carnosina y, como puede ser convertido en piruvato, participa indirectamente en la regulación de la glicemia o como fuente de energía para el músculo esquelético.
Se utiliza como suplemento dietético para mejorar el rendimiento deportivo y se encuentra naturalmente en las carnes de vaca, cerdo y pescado, así como en la leche y sus derivados y en los huevos. Algunas legumbres, frutas y frutos secos también son ricos en alanina.
Índice del artículo
Se comentó anteriormente que la alanina, como todos los aminoácidos, tiene un carbono α con cuatro grupos unidos a él, siendo el grupo R un grupo metilo (—CH3).
Por lo tanto, al pH corporal (alrededor de 7.4) el carbono α de la alanina está unido a un grupo amino protonado (—NH3+), a un grupo carboxilo que ha perdido un protón (—COO-), a un hidrógeno y a un grupo metilo (—CH3).
La mayoría de los aminoácidos son ionizables a pH 7.0 y geométricamente pueden tener isómeros, que se conocen como enantiómeros, que son imágenes especulares, tal y como ocurre con la mano derecha e izquierda.
Entonces, todos los aminoácidos pueden encontrarse como “parejas quirales” denotadas como D o L (dextro y levo, respectivamente), según la posición de los átomos que rodean al carbono α.
Sin embargo, la alanina, como ocurre con la mayor parte de los aminoácidos, se encuentra mayoritariamente en la forma L, puesto que es la forma que las enzimas insertan durante la síntesis proteica.
Este aminoácido puede encontrarse también como β–alanina, en el que el grupo amino está unido a su carbono β, es decir, al primer carbono de su cadena lateral.
La β-Alanina se encuentra en el ácido pantoténico (vitamina B5) y en algunos péptidos naturales. La D-Alanina se encuentra en algunos polipéptidos que forman parte de las paredes de algunas células bacterianas.
El grupo metilo de la cadena lateral de la alanina es un hidrocarburo saturado que le da la característica hidrofóbica apolar a este aminoácido. Esta característica de la alanina es común con los otros aminoácidos de este grupo como son la glicina, la valina, la leucina y la isoleucina.
Los aminoácidos que conforman el grupo de los alifáticos son aminoácidos químicamente neutros y juegan un papel muy importante en la formación y el mantenimiento de la estructura tridimensional de las proteínas ya que tienen la tendencia de reaccionar entre sí excluyendo al agua.
Estos aminoácidos, incluyendo la alanina, contienen el mismo número de grupos ionizables con cargas opuestas, por lo que no poseen carga neta y se denominan “zwitteriones”.
Como la mayoría de los aminoácidos conocidos, la alanina se utiliza en la síntesis de péptidos y proteínas en general, y participa en el establecimiento de la estructura polipeptídica y en la estructura terciaria de algunas proteínas.
Otra de las funciones importantes de la alanina es la de participar indirectamente en el control de la glicemia:
Puede dar origen a piruvato y viceversa, también puede llegar al hígado y convertirse en glucosa por la vía de la gluconeogénesis para ser vertida a la circulación o para emplearse en la síntesis de glucógeno, según sea necesario.
La alanina participa como transportador de amonio desde el músculo hacia el hígado, puesto que puede ser sintetizada por aminación a partir de piruvato, transportarse al hígado y allí ser transformada por transaminación.
Esto ocurre concomitantemente con la transformación del α-cetoglutarato a glutamato, que puede ingresar al ciclo de la urea y convertirse de nuevo en piruvato.
Este aminoácido es indispensable para la síntesis de triptófano y de piridoxina. Aunque es químicamente muy poco reactiva, la alanina puede tener funciones de reconocimiento de sustrato y de regulación enzimática.
Una de las funciones de la β-alanina es la de suplemento dietético, pues se utiliza como ayuda ergogénica del ejercicio. La ingesta de β-alanina aumenta la concentración de carnosina (un dipéptido formado por β-alanina e histidina) en el músculo esquelético, actuando como “buffer”.
Normalmente, la carnosina no contribuye de manera importante en la capacidad buffer total de la célula muscular y esto es debido a su baja concentración. La administración de β-alanina aumenta esta concentración y por ende la capacidad buffer, por lo que mejora la resistencia al disminuir la fatiga.
La síntesis más importante de alanina en el cuerpo humano ocurre por una aminación reductiva del ácido pirúvico. Esta reacción requiere de un solo paso enzimático.
El piruvato aporta el esqueleto de carbono y el glutamato aporta el grupo amino que es transferido al piruvato. La enzima que cataliza esta reacción reversible es la alanina transaminasa.
Como resultado de esta reacción se produce alanina y α-cetoglutarato. La alanina puede estar presente entonces en la gluconeogénesis, en la glicólisis y en el ciclo de Krebs.
Otra fuente de alanina proviene de la degradación del triptófano a acetil-CoA. En esta ruta, cuando la enzima quinureninasa hidroliza a la 3-hidroxi quinurenina se forma 3-hidroxi antranilato y alanina. La alanina se libera y el 3-hidroxi antranilato sigue la ruta metabólica.
La degradación del uracilo es otra fuente de alanina. En este caso se produce β-alanina que puede seguir varias vías metabólicas, una de ellas es la de convertirse en acetil-CoA.
Los aminoácidos no se almacenan como los carbohidratos y las grasas, por lo que aquellos que se liberan durante la degradación de las proteínas deben ser reutilizados para la síntesis de nuevas proteínas y de nucleótidos.
Por otro lado, los aminoácidos pueden ser degradados y sus esqueletos carbonados pueden ser empleados en reacciones catabólicas o anabólicas.
Cuando los aminoácidos son degradados el exceso de nitrógeno forma amoniaco, que es una sustancia tóxica que debe ser eliminada y el primer paso de la degradación de aminoácidos es la eliminación del nitrógeno.
En los mamíferos, esta degradación ocurre en el hígado; allí, todo aminoácido que esté en exceso y no pueda utilizarse es degradado.
La degradación de la alanina ocurre por la conversión de la alanina en piruvato. Esta reacción es catalizada por la alanina transaminasa y requiere de la presencia de α-cetoglutarato como aceptor del grupo amino y la formación subsecuente de glutamato; la misma es una reacción reversible.
Estas reacciones de formación de alanina a partir de piruvato y de degradación de alanina para formar piruvato forman parte de un ciclo que involucra al músculo esquelético y al hígado.
El hígado surte de glucosa al músculo y el músculo, a través de la glucólisis, convierte la glucosa en piruvato con el objeto de generar ATP; este piruvato puede entrar en la síntesis de alanina, que puede ser vertida al torrente circulatorio y vuelve al hígado que la convierte otra vez en piruvato, que entra en la gluconeogénesis para formar glucosa.
Si es necesario el ciclo se repite. En el hígado, la producción de piruvato a partir de alanina genera iones amonio que se fijan en la glutamina y el glutamato y estos entran en el ciclo de la urea. Luego la urea es eliminada por la orina.
La alanina, la glicina, la cisteína, la serina y la treonina son aminoácidos glucogénicos ya que su degradación puede dar origen a piruvato, a α-cetoglutarato, a succinil-CoA, a fumarato u oxalacetato, todos precursores gluconeogénicos de la glucosa.
Las principales fuentes de aminoácidos son las carnes magras, los pescados, los mariscos, los huevos y los productos lácteos, sin embargo, la alanina se encuentra también en muchos alimentos de origen vegetal. Ejemplo de alimentos ricos en alanina son:
– Carnes como la de vaca, cerdo, ovino, pollo, pavo, conejo, pescado; huevos, leche y derivados.
– Frutos secos como las avellanas, las nueces, las castañas, las almendras y el maní son fuentes de alanina.
– El coco, el aguacate, los espárragos, la berenjena, la yuca o mandioca, la remolacha, la zanahoria y la batata.
– Legumbres como el maíz, los frijoles y las arvejas.
– Cereales como el arroz, el centeno, el trigo, el cacao, la avena y el centeno.
- Caruso, J., Charles, J., Unruh, K., Giebel, R., Learmonth, L., & Potter, W. (2012). Ergogenic effects of β-alanine and carnosine: Proposed future research to quantify their efficacy. Nutrients, 4(7), 585–601.
- Gille, C., Bölling, C., Hoppe, A., Bulik, S., Hoffmann, S., Hübner, K., … Holzhütter, H. G. (2010). HepatoNet1: A comprehensive metabolic reconstruction of the human hepatocyte for the analysis of liver physiology. Molecular Systems Biology, 6(411), 1–13.
- Mathews, C., van Holde, K., & Ahern, K. (2000). Biochemistry (3th ed.). San Francisco, California: Pearson.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Harper’s Illustrated Biochemistry (28th ed.). McGraw-Hill Medical.
- Nelson, D. L., & Cox, M. M. (2009). Lehninger Principios de Bioquímica. Ediciones Omega (5th ed.).
