Momento dipolar: cómo se calcula y ejemplos
El momento dipolar es una propiedad química que indica cuán heterogéneamente están distribuidas las cargas eléctricas en una molécula. Viene expresada en unidades de Debye, 3,33·10-30 C·m, y por lo general sus valores oscilan desde 0 a 11 D.
Los compuestos altamente polares tienden a tener momentos dipolares grandes; mientras que los apolares, momentos dipolares pequeños. Cuanto más polarizadas estén las cargas eléctricas en una molécula, mayor será su momento dipolar; es decir, debe haber una región rica en electrones, δ-, y otra pobre en electrones, δ+.

El momento dipolar, μ, es una magnitud vectorial, por lo que se ve afectada por los ángulos de los enlaces y, en general, por la estructura molecular.
Cuando la molécula es lineal, puede compararse a un borrador de dos colores. Su extremo negativo δ-, correspondería al color rojo; mientras que el positivo, δ+, vendría a ser el color azul. A medida que se incrementa las magnitudes de las cargas negativas en el polo δ-, y la distancia que lo separa de δ+, el momento dipolar aumenta.
Químicamente lo anterior significa que cuanto mayor sea la diferencia de electronegatividad entre dos átomos, y más larga sea la distancia que los separa, mayor será el momento dipolar existente entre ellos.
Índice del artículo
Se considera un enlace covalente entre dos átomos, A y B:
A-B
La distancia entre las cargas parciales positivas y negativas ya viene definida por la longitud de su enlace:
Aδ+-Bδ-
Debido a que los protones y los electrones tienen la misma magnitud de carga eléctrica pero con signos opuestos, 1.6·10-19C, esta es la que se toma en cuenta al evaluar el momento dipolar entre A y B mediante la siguiente ecuación:
μ = δ·d
Donde μ es el momento dipolar, δ es la carga del electrón sin el signo negativo, y d la longitud del enlace expresada en metros. Por ejemplo, asumiendo que d tiene un valor de 2 Å (1·10-10m) el momento dipolar, μA-B será:
μA-B = (1.6·10-19C)·(2·10-10m)
= 3,2·10-29C·m
Pero dado que este valor es muy pequeño, se recurre a la unidad del Debye:
μ = (3,2·10-29C·m)·(1 D/3,33·10-30 C·m)
=9,60 D
Este valor de μA-B podría dar a suponer que el enlace A-B es más iónico que covalente.
Para calcular el momento dipolar de una molécula hay que sumar vectorialmente todos los momentos dipolares de sus respectivos enlaces, considerando los ángulos de enlaces y un poco de trigonometría. Esto en un principio.
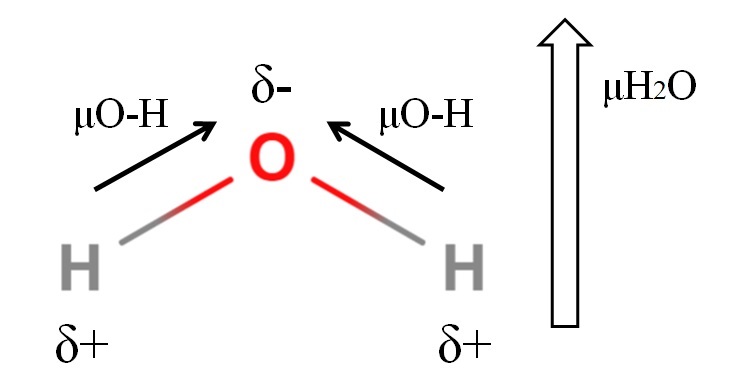
El agua posee uno de los mayores momentos dipolares que podría esperarse para un compuesto covalente. En la imagen superior tenemos que los átomos de hidrógeno tienen cargas parciales positivas, δ+, mientras que el oxígeno porta la carga parcial negativa, δ-. El enlace O-H es bastante polar (1.5D), y hay dos de ellos en una molécula de H2O.
Por lo general, se dibuja un vector que se dirige desde el átomo menos electronegativo (H) hacia el más electronegativo (O). Aunque no se dibujen, sobre el átomo de oxígeno hay dos pares de electrones no compartidos, los cuales “concentran” todavía más la región negativa.
Debido a la geometría angular del H2O, los momentos dipolares se suman en dirección del átomo de oxígeno. Nótese que la sumatoria de los dos μO-H daría 3D (1.5+1.5); pero no es así. El momento dipolar del agua tiene un valor experimental de 1.85D. Aquí se muestra el efecto que tiene el ángulo cercano de 105º entre los enlaces H-O-H.
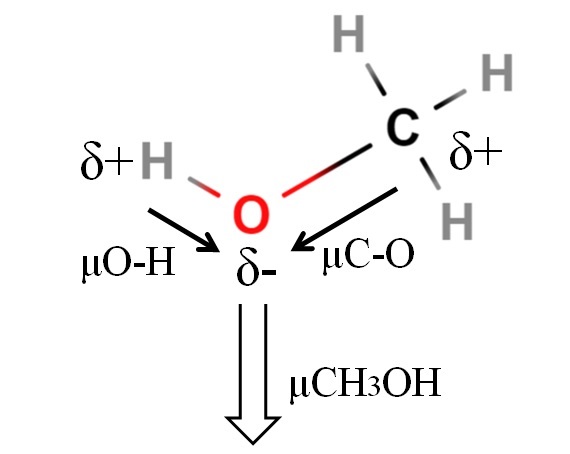
El momento dipolar del metanol es de 1.69D. Es menor que el del agua. Por lo tanto, las masas atómicas no tienen demasiada influencia en el momento dipolar; pero sí sus radios atómicos. En el caso del metanol, no podemos afirmar que su enlace H-O tenga un μ igual a 1.5D; ya que, los entornos moleculares son distintos en el CH3OH y H2O.
Es por eso que habría que medir la longitud del enlace H-O en el metanol para poder calcular μO-H. Lo que sí puede afirmarse es que μO-H es más grande que μC-O, pues la diferencia de electronegatividad entre el carbono y oxígeno es menor que entre el hidrógeno y oxígeno.
El metanol se cataloga como uno de los solventes más polares que puede encontrarse junto con el agua y el amoníaco.
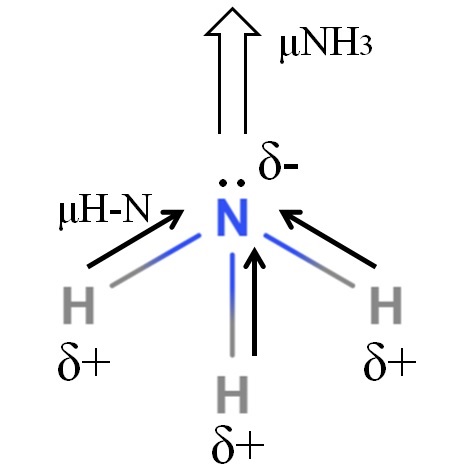
Los enlaces H-N son bastante polares, por lo que el nitrógeno a raíz de su mayor electronegatividad atrae los electrones hacia sí (imagen superior). Además de esto, sobre él tenemos un par de electrones no compartido, que aportan sus cargas negativas a la región δ-. Por lo tanto, las cargas eléctricas predominan en el átomo de nitrógeno del amoníaco.
El amoníaco tiene un momento dipolar de 1.42D, menor que el del metanol. Si tanto el amoníaco como el metanol pudieran transformarse en borradores, se vería que el borrador del metanol presenta polos más definidos en comparación al borrador del amoníaco.
En el caso del etanol, CH3CH2OH se tiene que su momento dipolar es muy cercano al del metanol, pero tiende a tener valores inferiores. Al haber más átomos de carbono componiendo la región δ+, el átomo de oxígeno representando a δ-, comienza a perder un poco de su “intensidad negativa relativa”.
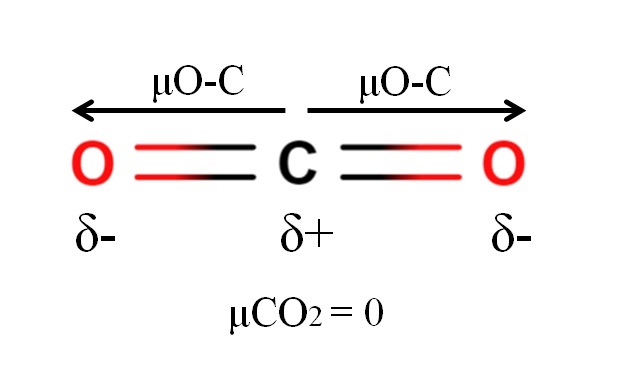
El dióxido de carbono tiene dos enlaces polares, C=O, con sus respectivos momentos dipolares μO-C. No obstante, como se aprecia en la imagen superior, la geometría lineal del CO2 hace que vectorialmente los dos μO-C se cancelen entre sí, aun cuando el carbono tenga carga parcial positiva y los oxígenos cargas parciales negativas.
Por esta razón el dióxido de carbono es una molécula apolar, pues μCO2 tiene un valor de 0D.
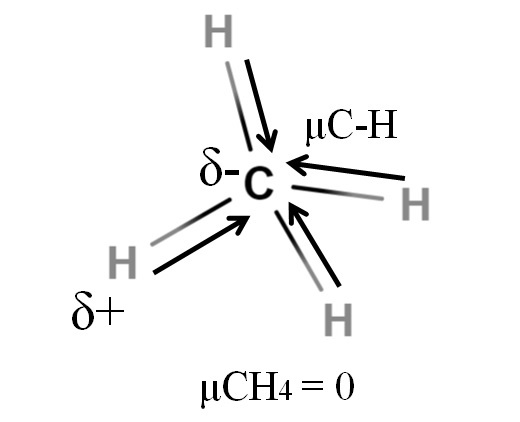
Tanto el metano como el dióxido de carbono comparten algo en común: son moléculas altamente simétricas. Por lo general, mientras más simétrica sea una molécula, menor será su momento dipolar.
Si vemos la molécula de CH4, sus enlaces C-H son polares, y los electrones se dirigen hacia el átomo de carbono por ser levemente más electronegativo. Podría pensarse que el carbono tendría que ser una región δ- altamente negativa; como un borrador con su centro de color rojo intenso y sus extremos azulados.
No obstante, al dividirse el CH4 por la mitad obtendríamos dos mitades H-C-H, una a la izquierda y la otra la derecha, similares a la molécula H2O. Así pues, el momento dipolar resultante de sumar estos dos μC-H se cancelería con el de la otra mitad. Y por lo tanto, μCH4 tiene un valor de 0D.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Walter J. Moore. (1963). Physical Chemistry. In Chemical kinetics. Fourth edition, Longmans.
- Ira N. Levine. (2009). Principios de fisicoquímica. Sexta edición, pág 479-540. Mc Graw Hill.
- Helmenstine, Anne Marie, Ph.D. (29 de enero de 2020). Dipole Moment Definition. Recuperado de: thoughtco.com
- Blaber Mike. (29 de septiembre de 2019). Dipole Moments. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- LaRita Williams. (2020). Dipole Moment: Definition, Equation & Examples. Study. Recuperado de: study.com
- Wikipedia. (2020). Bond dipole moment. Recuperado de: en.wikipedia.org
