50 Ejemplos de ácidos y bases
Son cientos los ejemplos de ácidos y bases que pueden encontrarse en todas las ramas de la química, pero que en su conjunto se separan en dos grandes familias: inorgánicos y orgánicos. A los ácidos inorgánicos se les conoce usualmente como ácidos minerales, caracterizados por ser especialmente fuertes comparados con los orgánicos.
Se entiende por ácidos y bases como sustancias que tienen sabores agrios o saponáceos, respectivamente. Ambos son corrosivos, aunque suele utilizarse la palabra ‘cáustico’ para las bases fuertes. En resumidas cuentas: queman y corroen la piel si la tocan. Sus características en medios disolventes han pautado una serie de definiciones a lo largo de la historia.
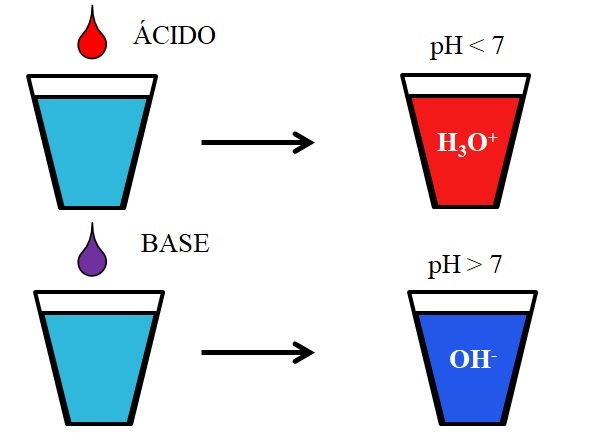
En la imagen inferior se muestra el comportamiento genérico de los ácidos y bases cuando se agregan o disuelven en un vaso con agua. Los ácidos producen soluciones con valores de pH por debajo de 7 debido a los iones hidronios, H3O+; mientras que las bases, producen soluciones con pH arriba de 7 debido a los iones hidroxilo (u oxidrilo), OH–.
Si añadimos ácido clorhídrico, HCl (gota roja), al vaso, habrá iones H3O+ y Cl– hidratados. En cambio, si repetimos el experimento con hidróxido de sodio, NaOH (gota morada), tendremos iones OH– y Na+.
Índice del artículo

Las características, cada vez más estudiadas y comprendidas, de los ácidos y bases sentaron más de una definición para estos compuestos químicos. Entre estas definiciones tenemos la de Arrhenius, la de Bronsted-Lowry, y por último la de Lewis. Antes de citar los ejemplos es necesario tener esto claro.
Los ácidos y bases, de acuerdo a Arrhenius, son aquellos que disueltos en agua producen iones H3O+ o OH–, respectivamente. Es decir, la imagen ya representa esta definición. Sin embargo, por sí sola desprecia algunos ácidos o bases demasiado débiles para producir tales iones. Es aquí donde entra la definición de Bronsted-Lowry.
Los ácidos de Bronsted-Lowry son aquellos que pueden donar iones H+, y las bases son aquellas que aceptan estos H+. Si un ácido dona con mucha facilidad sus H+, significa que es un ácido fuerte. Lo mismo sucede con las bases, pero aceptando H+.
Es así que tenemos ácidos y bases fuertes o débiles, y sus fuerzas se miden en diferentes solventes; especialmente en el agua, de la cual se establecen las unidades de pH conocidas (de 0 a 14).
Por lo tanto, un ácido fuerte HA donará completamente su H+ al agua en una reacción del tipo:
HA + H2O => A– + H3O+
Donde A– es la base conjugada de HA. De aquí proviene pues el H3O+ presente en el vaso con solución ácida.
Mientras, una base débil B desprotonará al agua para ganar su respectivo H+:
B + H2O => HB + OH–
Donde HB es el ácido conjugado de B. Este es el caso del amoníaco, NH3:
NH3 + H2O => NH4+ + OH–
Una base muy fuerte puede donar directamente los iones OH– sin necesidad de reaccionar con el agua; tal como ocurre con el NaOH.
Finalmente, los ácidos de Lewis son aquellos que ganan o aceptan electrones, y las bases de Lewis son aquellas que donan o pierden electrones.
Por ejemplo, la base de Bronsted-Lowry NH3 también es una base de Lewis, ya que el átomo de nitrógeno acepta un H+ al donar a este su par de electrones libres (H3N: H+). Es por eso que las tres definiciones no discrepan entre sí, sino que se entrelazan y ayudan a estudiar la acidez y basicidad en un espectro más amplio de compuestos químicos.
Habiéndose aclarado las definiciones, se mencionarán a continuación una serie de ácidos con sus respectivas fórmulas y nombres:
-HF: ácido fluorhídrico
-HBr: ácido bromhídrico
-HI: ácido yodhídrico
-H2S: ácido sulfhídrico
-H2Se: ácido selenhídrico
-H2Te: ácido telurhídrico
Estos son los ácidos binarios, también llamados hidrácidos, al que pertenece el ya citado ácido clorhídrico, HCl.
-HNO3: ácido nítrico
-HNO2: ácido nitroso
-HNO: ácido hiponitroso
-H2CO3: ácido carbónico
-H2CO2: ácido carbonoso, el cual en realidad se conoce más por el nombre de ácido fórmico, HCOOH, el ácido orgánico más simple de todos
-H3PO4: ácido fosfórico
-H3PO3 o H2[HPO3]: ácido fosforoso, con un enlace H-P
-H3PO2 o H[H2PO2]: ácido hipofosforoso, con dos enlaces H-P
-H2SO4: ácido sulfúrico
-H2SO3: ácido sulfuroso
-H2S2O7: ácido disulfúrico
-HIO4: ácido peryódico
-HIO3: ácido yódico
-HIO2: ácido yodoso
-HIO: ácido hipoyodoso
-H2CrO4: ácido crómico
-HMnO4: ácido mangánico
-CH3COOH: ácido acético (vinagre)
-CH3SO3H: ácido metanosulfónico
Todos estos ácidos, excepto el fórmico y los últimos dos, se conocen como oxácidos o ácidos ternarios.
Otros:
-AlCl3: cloruro de aluminio
-FeCl3: cloruro férrico
-BF3: trifluoruro de boro
-Cationes metálicos disueltos en agua
-Carbocationes
-H(CHB11Cl11): carborano superácido
– FSO3H: ácido fluorosulfónico
– HSbF6: ácido fluoroantimónico
– FSO3H·SbF5: ácido mágico
Los últimos cuatro ejemplos conforman los temibles súper ácidos; compuestos capaces de desintegrar casi cualquier material con apenas tocarlo. El AlCl3 es un ejemplo de ácido de Lewis, ya que el centro metálico de aluminio es capaz de aceptar electrones debido a su deficiencia electrónica (no completa su octeto de valencia).
Entre las bases inorgánicas tenemos los hidróxidos metálicos, como el hidróxido de sodio, y algunos hidruros moleculares, como el amoníaco ya citado. A continuación mencionamos otros ejemplos de bases:
-KOH: hidróxido de potasio
-LiOH: hidróxido de litio
-RbOH: hidróxido de rubidio
-CsOH: hidróxido de cesio
-FrOH: hidróxido de francio
-Be(OH)2: hidróxido de berilio
-Mg(OH)2: hidróxido de magnesio
-Ca(OH)2: hidróxido de calcio
-Sr(OH)2: hidróxido de estroncio
-Ba(OH)2: hidróxido de bario
-Ra(OH)2: hidróxido de radio
-Fe(OH)2: hidróxido ferroso
-Fe(OH)3: hidróxido férrico
-Al(OH)3: hidróxido de aluminio
-Pb(OH)4: hidróxido plúmbico
-Zn(OH)2: hidróxido de cinc
-Cd(OH)2: hidróxido de cadmio
-Cu(OH)2: hidróxido cúprico
-Ti(OH)4: hidróxido titánico
-PH3: fosfina
-AsH3: arsina
-NaNH2: amiduro de sodio
– C5H5N: piridina
-(CH3)N: trimetilamina
– C6H5NH2: fenilamina o anilina
-NaH: hidruro de sodio
-KH: hidruro de potasio
-Carbaniones
-Li3N: nitruro de litio
-Alcóxidos
-[(CH3)2CH]2NLi: diisopropilamida de litio
-Anión dietinilbenceno: C6H4C42- (la base más fuerte conocida hasta ahora)
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Naomi Hennah. (10 de octubre de 2018). How to teach acids, bases and salts. Recuperado de: edu.rsc.org
- Helmenstine, Anne Marie, Ph.D. (31 de agosto de 2019). Formulas of Common Acids and Bases. Recuperado de: thoughtco.com
- David Wood. (2019). Comparing Common Acids & Bases. Study. Recuperado de: study.com
- Ross Pomeroy. (23 de agosto de 2013). The World’s Strongest Acids: Like Fire and Ice. Recuperado de: realclearscience.com
- Wikipedia. (2019). Diethynylbenzene dianion. Recuperado de: en.wikipedia.org
