Diagrama de Moeller: qué es, en qué consiste y ejercicios resueltos
¿Qué es el diagrama de Moeller?
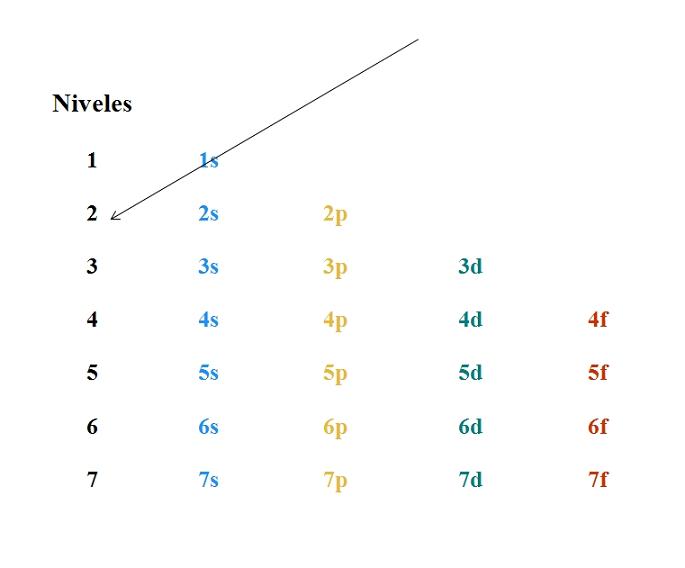
El diagrama de Moeller es un método gráfico y nemotécnico para aprender la regla de Madelung; esto es, cómo escribir la configuración electrónica de un elemento. Se caracteriza por trazar unas diagonales por las columnas de los orbitales, y siguiendo la dirección de la flecha se establece el orden apropiado de los mismos para un átomo.
En algunas partes del mundo al diagrama de Moeller también se le conoce como método de la lluvia. A través de este, se define un orden en el llenado de los orbitales, los cuales están definidos por los tres números cuánticos n, l y ml.
En la imagen superior se muestra un diagrama de Moeller simple. Cada columna corresponde a distintos orbitales: s, p, d y f, con sus respectivos niveles de energía. La flecha señala que el llenado de cualquier átomo debe empezar por el orbital 1s.
Así, la siguiente flecha debe empezar por el orbital 2s, y luego por el 2p pasando por el orbital 3s. De esta manera, como si fuera una lluvia, se van anotando los orbitales y el número de electrones que albergan (4l+2).
El diagrama de Moeller es una introducción para quienes estudian las configuraciones electrónicas.
¿En qué consiste el diagrama de Moeller?
Regla de Madelung
Debido a que el diagrama de Moeller es una representación gráfica de la regla de Madelung, es necesario conocer cómo funciona esta última. El llenado de los orbitales debe obedecer las siguientes dos reglas:
– Los orbitales con los menores valores de n+l se llenan primero, siendo n el número cuántico principal, y l el momento angular orbital. Por ejemplo, el orbital 3d corresponde a n=3 y l=2, por lo tanto, n+l= 3+2=5; mientras, el orbital 4s corresponde a n=4 y l=0, y n+l= 4+0=4. De lo anterior se establece que los electrones llenan primero el orbital 4s que el 3d.
– Si dos orbitales tienen el mismo valor de n+l, los electrones ocuparán primero aquel con menor valor de n. Por ejemplo, el orbital 3d tiene un valor de n+l=5, al igual que el orbital 4p (4+1=5); pero como el 3d tiene el menor valor de n, se llenará primero que el 4p.
De las dos observaciones anteriores se puede llegar al siguiente orden de llenado de los orbitales: 1s 2s 2p 3s 3p 4s 3d 4p.
Siguiendo los mismos pasos para diferentes valores de n+l para cada orbital se obtienen las configuraciones electrónicas de otros átomos; las cuales a su vez pueden también determinarse por el diagrama de Moeller gráficamente.
Pasos a seguir
La regla de Madelung establece la fórmula n+l, con la cual puede “armarse” la configuración electrónica. Sin embargo, como se ha dicho, el diagrama de Moeller ya representa gráficamente esto; de modo que basta con seguir sus columnas y dibujar diagonales paso a paso.
Hay que tener en cuenta que cada tipo de orbital cuenta con una capacidad distinta para albergar electrones; de esta manera, tenemos:
s = 2 electrones
p = 6 electrones
d = 10 electrones
f = 14 electrones
Se detiene en el orbital donde se haya ocupado el último electrón dado por Z.
¿Cómo se empieza la configuración electrónica de un átomo? Para ello, se debe primero conocer su número atómico Z, que, por definición, para un átomo neutro es igual al número de electrones.
Así, con Z se obtiene el número de electrones, y con esto en mente se comienzan a trazar diagonales por el diagrama de Moeller.
Para mayor esclarecimiento, a continuación se tienen una serie de ejercicios resueltos.
Ejercicios resueltos
Berilio
Empleando la tabla periódica, se ubica el elemento berilio con un Z=4; es decir, se debe dar alojo a sus cuatro electrones en los orbitales.
Iniciando entonces con la primera flecha en el diagrama de Moeller, el orbital 1s ocupa dos electrones: 1s2; seguido del orbital 2s, con dos electrones adicionales para sumar 4 en total: 2s2.
Por lo tanto, la configuración electrónica del berilio, expresada como [Be] es 1s22s2. Nótese que la sumatoria de superíndices es igual al número de electrones totales.
Fósforo
El elemento fósforo tiene un Z=15, y en consecuencia, tiene 15 electrones en total, los cuales deben ocupar los orbitales. Para adelantar camino, se empieza de una vez con la configuración 1s22s2, la cual contiene 4 electrones. Faltarían entonces 9 electrones más.
Después del orbital 2s, la siguiente flecha “entra” por el orbital 2p, cayendo finalmente en el orbital 3s. Como los orbitales 2p pueden ocupar 6 electrones, y los 3s 2 electrones, se tiene: 1s22s22p63s2.
Todavía faltan 3 electrones más, los cuales ocupan el siguiente orbital 3p según el diagrama de Moeller: 1s22s22p63s23p3, configuración electrónica del fósforo [P].
Zirconio
El elemento zirconio tiene un Z=40. Acortando camino con la configuración 1s22s22p63s23p6, con 18 electrones (la del gas noble argón), faltarían entonces 22 electrones más.
Después del orbital 3p, los siguientes en llenarse de acuerdo al diagrama de Moeller son los orbitales 4s, 3d, 4p y 5s.
Llenándolos por completo, es decir, 4s2, 3d10, 4p6 y 5s2, se suma un total de 20 electrones. Los 2 electrones restantes se alojan, por lo tanto, en el siguiente orbital: el 4d. Así, la configuración electrónica del zirconio [Zr], es: 1s22s22p63s23p64s23d104p65s24d2.
Iridio
El iridio tiene un Z=77, por lo que tiene 37 electrones adicionales respecto al zirconio. Partiendo de [Cd], es decir, 1s22s22p63s23p64s23d104p65s24d10, hay que sumar 29 electrones con los siguientes orbitales del diagrama de Moeller.
Trazando nuevas diagonales, los nuevos orbitales son: 5p, 6s, 4f y 5d. Llenando los tres primeros orbitales completamente se tiene: 5p6, 6s2 y 4f14, para dar un total de 22 electrones.
De manera que faltan 7 electrones, los cuales están en el orbital 5d: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d7.
La anterior es la configuración electrónica del iridio, [Ir]. Nótese que los orbitales 6s2 y 5d7 se resaltan en negritas para indicar que corresponden propiamente a la capa de valencia de este metal.
Excepciones al diagrama de Moeller y la regla de Madelung
Existen en la tabla periódica muchos elementos que no obedecen a lo que se ha explicado recientemente. Sus configuraciones electrónicas difieren experimentalmente de las predichas por razones cuánticas.
Entre los elementos que presentan estas discordancias están: cromo (Z=24), cobre (Z=29), plata (Z=47), rodio (Z=45), cerio (Z=58), niobio (Z=41) y muchos más.
Las excepciones son muy frecuentes en el llenado de los orbitales d y f. Por ejemplo, el cromo debería tener una configuración de valencia 4s23d4 según el diagrama de Moeller y la regla de Madelung, pero en realidad es 4s13d5.
Asimismo, y para finalizar, la configuración de valencia de la plata debería ser 5s24d9; pero realmente es 5s14d10.
Referencias
- Misuperclase (s.f.) ¿Qué es la configuración electrónica? Recuperado de misuperclase.com
- Diagrama de Moeller. Recuperado de es.wikipedia.org
- How to represent electrons in an energy level diagram. Recuperado de dummies.com
