Alosterismo: aspectos generales, funciones y ejemplos
El alosterismo o regulación alostérica se define como el proceso de inhibición o activación de una enzima mediado por una molécula reguladora diferente a su sustrato y que actúa en un sitio específico de su estructura, diferente al sitio activo de la misma.
El término “alostérico” u “alosterismo” proviene de las raíces griegas “allos”, que quiere decir “otro” y “stereós”, que significa “forma” o “lugar”; por lo que se traduce literalmente como “otro espacio”, “otro lugar” u “otra estructura”.
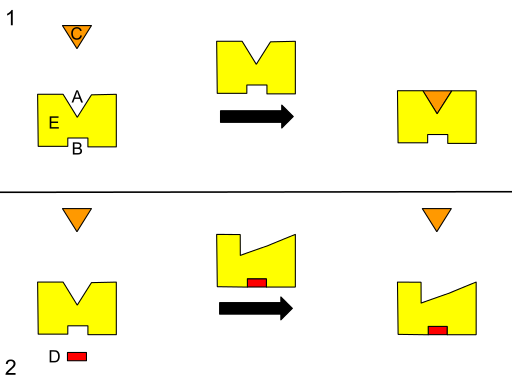
Algunos autores describen al alosterismo como un proceso por el cual sitios remotos en un sistema (la estructura de una enzima, por ejemplo) están acoplados energéticamente para producir una respuesta funcional, razón por la cual puede suponerse que un cambio en una región puede afectar a cualquier otra en el mismo.
Este tipo de regulación es típico de las enzimas que participan en múltiples procesos biológicos conocidos, tal y como la transducción de señales, el metabolismo (anabolismo y catabolismo), la regulación de la expresión genética, entre otros.
Las primeras ideas sobre el alosterismo y su participación en el control del metabolismo celular fueron postuladas en la década de 1960 por F. Monod, F. Jacob y J. Changeux, mientras estudiaban las rutas biosintéticas de distintos aminoácidos, las cuales eran inhibidas tras la acumulación de los productos finales.
Aunque la primera publicación al respecto tuvo que ver con la regulación genética, poco tiempo después Monod, Wyman y Changeux ampliaron la concepción de alosterismo a las proteínas con actividad enzimática y propusieron un modelo basado en proteínas multiméricas, sustentado principalmente en las interacciones entre las subunidades cuando cualquiera de estas se unía a un efector.
Muchos de los conceptos posteriores tuvieron sus basamentos en la teoría de “ajuste inducido” que fue introducida por Koshland unos años antes.
Índice del artículo
Por lo general, todas las enzimas poseen dos sitios diferentes para la unión de ligandos: uno se conoce como el sitio activo, al cual se unen las moléculas que funcionan como sustrato (responsable por la actividad biológica de la enzima), y el otro se conoce como sitio alostérico, que es específico para otros metabolitos.
Estos “otros metabolitos” se denominan efectores alostéricos y pueden tener efectos positivos o negativos en la velocidad de las reacciones catalizadas por las enzimas o en la afinidad con la que se unen a sus sustratos en el sitio activo.
Usualmente, la unión de un efector en el sitio alostérico de una enzima causa un efecto en otro sitio de la estructura, modificando su actividad o su desempeño funcional.
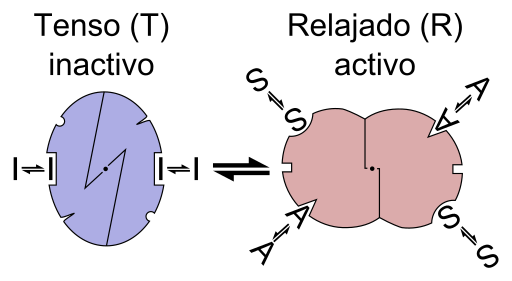
En otras palabras, la unión de un efector alostérico a su sitio específico en la estructura de una enzima provoca una cambio en la geometría molecular de la enzima, lo que se conoce como transición alostérica, es decir, es un evento que se transmite por toda la macromolécula, modificando su comportamiento.
El alosterismo puede ser homotrópico o heterotrópico. Un proceso de regulación alostérica homotrópica se define como aquel en el cual el mismo sustrato de una enzima actúa como su regulador alostérico, es decir, que el efector alostérico es el mismo sustrato; también se conoce como un tipo de cooperatividad.
Un proceso de regulación heterotrópica, por otra parte, se refiere a la regulación de la actividad de una enzima mediada por una molécula o efector alostérico que es diferente a su sustrato, y también puede tener efectos positivos o negativos sobre la actividad de la enzima.
El alosterismo, junto con la regulación de la expresión genética, de la traducción, y de la degradación proteica, es uno de los mecanismos fundamentales para la regulación de gran cantidad de procesos orgánicos, lo que es esencial para el mantenimiento de la homeostasis y para la supervivencia todos los seres vivos, unicelulares o multicelulares.
La regulación alostérica o el alosterismo les confiere a los organismos vivos la capacidad de responder con gran sensibilidad a los cambios en la concentración de ligandos reguladores, así como la de originar fenómenos rítmicos a nivel celular.
Puesto que la energía y los sustratos metabólicos son finitos en una célula, el alosterismo permite, en el ámbito metabólico, el empleo moderado de los recursos, evitando tanto ciclos inútiles como el desperdicio de energía para el procesamiento desmedido de sustratos en condiciones de abundancia o de escasez.
Del mismo modo, este mecanismo de regulación es de gran importancia para los procesos de señalización celular, en los cuales están implicados muchos cambios conformacionales que son disparados por la unión de diferentes ligandos en sitios específicos de los receptores en cuestión.
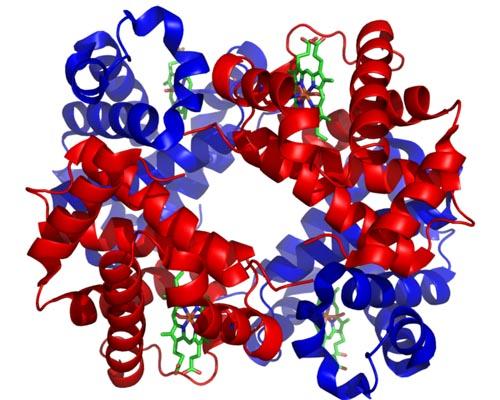
Aunque existen miles de ejemplos de alosterismo o regulación alostérica en la naturaleza, algunos han sido más destacados que otros. Tal es el caso de la hemoglobina, que fue una de las primeras proteínas descritas a profundidad en el aspecto estructural.
La hemoglobina es una proteína muy importante para muchos animales, pues se encarga del transporte de oxígeno por la sangre desde los pulmones hacia los tejidos. Esta proteína presenta regulación alostérica homotrópica y heterotrópica al mismo tiempo.
El alosterismo homotrópico de la hemoglobina tiene que ver con que la unión de una molécula de oxígeno a una de las subunidades que la componen afecta directamente la afinidad con la que se une la subunidad adyacente a otra molécula de oxígeno, incrementándola (regulación positiva o cooperativismo).
El alosterismo heterotrópico, por otra parte, se relaciona con los efectos que tienen tanto el pH como la presencia de 2,3-difosfoglicerato sobre la unión de oxígeno a las subunidades de esta enzima, inhibiéndola.
La aspartato transcarbamilasa o ATCasa, que participa en la ruta de síntesis de las pirimidinas, también es uno de los ejemplos “clásicos” de regulación alostérica. Esta enzima, que tiene 12 subunidades, de las cuales 6 son catalíticamente activas y 6 son reguladoras, es inhibida heterotrópicamente por el producto final de la ruta que encabeza, la citidinatrifosfato (CTP).
El fruto de las primeras ideas de Monod, Jacob y Changeux fue un artículo publicado por Jacob y Monod relacionado con el operón lactosa de Escherichia colii, que es uno de los ejemplos típicos de regulación alostérica heterotrópica a nivel genético.
La regulación alostérica de este sistema no se relaciona con la capacidad de conversión de un sustrato en un producto, sino con la afinidad de unión de una proteína a la región de ADN operadora.
- Changeux, J. P., & Edelstein, S. J. (2005). Allosteric mechanisms of signal transduction. Science, 308(5727), 1424-1428.
- Goldbeter, A., & Dupont, G. (1990). Allosteric regulation, cooperativity, and biochemical oscillations. Biophysical chemistry, 37(1-3), 341-353.
- Jiao, W., & Parker, E. J. (2012). Using a combination of computational and experimental techniques to understand the molecular basis for protein allostery. In Advances in protein chemistry and structural biology (Vol. 87, pp. 391-413). Academic Press.
- Kern, D., & Zuiderweg, E. R. (2003). The role of dynamics in allosteric regulation. Current opinion in structural biology, 13(6), 748-757.
- Laskowski, R. A., Gerick, F., & Thornton, J. M. (2009). The structural basis of allosteric regulation in proteins. FEBS letters, 583(11), 1692-1698.
- Mathews, C. K., Van Holde, K. E., & Ahern, K. G. (2000). Biochemistry, ed. San Francisco, Calif.
