¿Qué es la corrosión y cómo evitarla? (Métodos principales)
¿Qué es la corrosión?
Para saber cómo evitar la corrosión es importante saber qué es la corrosión y por qué se produce. Se llama corrosión al proceso natural en el que un metal se deteriora gradualmente por consecuencia de reacciones electroquímicas (o químicas) con su entorno.
Estas reacciones causan que los metales refinados busquen alcanzar una forma de mayor estabilidad o menor energía interna, que suelen ser sus versiones de óxido, hidróxido o sulfuro (por esto se dice que el metal se oxida). La corrosión también ocurre en materiales no metálicos como cerámicas y polímeros, pero es distinto y suele llamarse degradación.
La corrosión es un proceso enemigo del ser humano, ya que estos daños degradan los materiales, cambian su coloración y los debilitan, incrementando la posibilidad de ruptura e incremento de costos por reparación y reposición de los mismos.
Por esta razón existen campos enteros en la ciencia de los materiales que se dedican a la prevención de este fenómeno, como por ejemplo, la ingeniería de la corrosión. Los métodos para la prevención de la corrosión son variados y dependerán de los materiales afectados.
Métodos para evitar la corrosión
Primeramente debe tomarse en cuenta que no todos los metales se corroen a la misma velocidad, y algunos tienen la particularidad de no corroerse naturalmente en absoluto, como en el caso del acero inoxidable, el oro y el platino.
Esto sucede porque existen materiales para los que la corrosión es termodinámicamente desfavorable (es decir, no alcanzan mayor estabilidad con los procesos que los llevan a esto) o porque tienen una cinética de reacción tan lenta que los efectos de corrosión tardan en mostrarse.
Aun así, para los elementos que sí se corroen existe una serie de métodos para prevenir este proceso natural y darles mayor tiempo de vida:
Galvanizado
Es el método para prevención de corrosión en el que se recubre una aleación de hierro y acero con una capa delgada de zinc. El objetivo de este método es hacer que los átomos de zinc del recubrimiento reaccionen con las moléculas de aire, oxidándose y retardando la corrosión de la pieza que cubren.
Esta metodología convierte al zinc en un ánodo galvánico o ánodo de sacrificio, haciendo que este se exponga a la degradación por corrosión para salvar un material más valioso.
El galvanizado puede lograrse por inmersión de las partes metálicas en zinc fundido a altas temperaturas, como también en capas más delgadas que se consiguen con la electrogalvanización.
Esta última es la metodología que protege más, ya que el zinc queda unido al metal por procesos electroquímicos y no solo por procesos mecánicos como en la inmersión.
Pinturas y coberturas
La aplicación de pinturas, placas metálicas y esmaltes es otra forma de añadir una capa protectora a los metales propensos a la corrosión. Estas sustancias o capas generan una barrera de material anticorrosivo que se interpone entre el ambiente dañino y el material estructural.
Otras coberturas tienen propiedades específicas que las convierten en inhibidores de corrosión o anticorrosivos. Estos son añadidos a líquidos o gases primeramente, y luego son agregados en forma de capa sobre el metal.
Estos compuestos químicos son utilizados enormemente en la industria, sobre todo en las tuberías que transportan líquidos; además, pueden agregarse a aguas y refrigerantes para asegurar que estos no generen corrosión en los equipos y tuberías por los que pasan.
Anodización
Se trata de un procedimiento electrolítico de pasivación; es decir, el proceso a través del cual se forma una película algo inerte encima de la superficie de un elemento metálico. Este proceso se utiliza para incrementar el grosor de la capa natural de óxido que posee este material en su superficie.
Este proceso tiene la gran ventaja de no solo añadir protección contra corrosión y roce, sino que además proporciona una mayor adhesión para capas de pintura y pegamentos que el material descubierto.
A pesar de haber experimentado cambios y evoluciones con el tiempo, este proceso comúnmente se lleva a cabo introduciendo un objeto de aluminio en una solución electrolítica y haciendo pasar una corriente directa a través de esta.
Esta corriente hará que el ánodo de aluminio libere hidrógeno y oxígeno, generando óxido de aluminio que se unirá al mismo para incrementar el grosor de su capa superficial.
La anodización genera cambios en la textura microscópica de la superficie y en la estructura cristalina del metal, haciendo que se genere una alta porosidad en la misma.
Por esto, a pesar de mejorar la fuerza y resistencia a la corrosión del metal, también puede hacerlo más quebradizo, además de reducir su resistencia a altas temperaturas.
Biopelículas
Las biopelículas son grupos de microorganismos que se unen en forma de capa sobre una superficie, comportándose como un hidrogel pero sin dejar de representar una comunidad viva de bacterias u otros microorganismos.
Aunque estas formaciones suelen ser asociadas con la corrosión, en los últimos años ha habido un desarrollo en el uso de biopelículas bacterianas para proteger metales en ambientes altamente corrosivos.
Además, se han descubierto biopelículas con propiedades antimicrobianas, las cuales detienen los efectos de bacterias reductoras de sulfato.
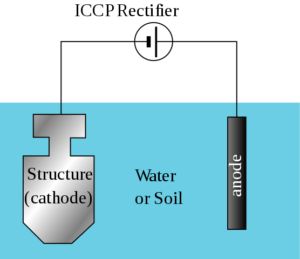
Sistemas de corrientes impresas
En aquellas estructuras muy grandes o donde la resistividad a electrolitos es alta, los ánodos galvánicos no pueden generar suficiente corriente para proteger toda la superficie, por lo que se usa un sistema de protección catódica por corrientes impresas.
Estos sistemas consisten en unos ánodos conectados a una fuente de poder de corriente directa, principalmente un transformador-rectificador conectado a una fuente de corriente alterna.
Este método es utilizado principalmente en cargueros y otras naves, las cuales requieren un alto nivel de protección en una mayor superficie de su estructura, como lo son las hélices, los timones y otras piezas de las que depende la navegación.
Cambios en las condiciones ambientales
Finalmente, la tasa de corrosión puede detenerse o reducirse con la alteración de las condiciones ambientales en las que se encuentra el material metálico.
La humedad y contenidos de azufre, cloruros y oxígeno en líquidos y gases deben mantenerse a bajos niveles para incrementar la expectativa de vida de un material, y usar agua menos salina y/o dura tiene un efecto positivo.
Referencias
- Wikipedia. (s.f.). Corrosion. Obtenido de en.wikipedia.org
- Balance, T. (s.f.). Corrosion Protection for Metals. Obtenido de thebalance.com
- Eoncoat. (s.f.). Corrosion Prevention Methods. Obtenido de eoncoat.com
- MetalSuperMarkets. (s.f.). How to Prevent Corrosion. Obtenido de metalsupermarkets.com
- Corrosionpedia. (s.f.). Impressed Current Cathodic Protection (ICCP). Obtenido de corrosionpedia.com
