¿Qué es el puntro triple? (ciclohexeno, agua, benceno)
¿Qué es el punto triple?
El punto triple es un término en el campo de la termodinámica que se refiere a la temperatura y presión en la cual existen simultáneamente tres fases de una sustancia en un estado de equilibrio termodinámico. Este punto existe para todas las sustancias, aunque las condiciones en las que se consiguen varían enormemente entre cada una.
Un punto triple también puede involucrar más de una fase del mismo tipo para una sustancia en específico; es decir, que se observen dos fases de sólido, fluido o gas distintas. El helio, en particular su isótopo helio-4, es un buen ejemplo de un punto triple involucrando dos fases de fluido individuales: fluido normal y superfluido.
¿Para qué sirve y cuándo se utiliza el punto triple?
El punto triple del agua es utilizado para definir al kelvin, la unidad base de temperatura termodinámica en el sistema internacional de unidades (SI). Este valor es fijado por definición en vez de medido.
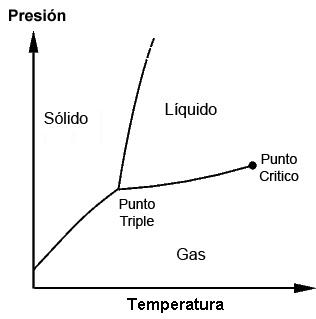
Los puntos triples de cada sustancia pueden ser observados con el uso de diagramas de fase, los cuales son gráficas trazadas que permiten demostrar las condiciones limitantes de las fases sólidas, líquidas, gaseosas (y otras, en casos especiales) de una sustancia mientras se le ejercen cambios de temperatura, presión y/o solubilidad.
Una sustancia se puede encontrar en su punto de fusión en el cual el sólido se encuentra con el líquido; también puede encontrarse en su punto de ebullición en el que el líquido se encuentra con el gas. Sin embargo, es en el punto triple en donde las tres fases se consiguen. Estos diagramas serán distintos para cada sustancia, como se verá más adelante.
El punto triple se puede utilizar de manera efectiva en la calibración de termómetros, haciendo uso de células de triple punto.
Estas son muestras de sustancias en condiciones aisladas (dentro de “células” de vidrio) que se encuentran en su punto triple con condiciones de temperatura y presión conocidas, y así facilitan el estudio de la precisión de las mediciones del termómetro.
También se ha utilizado el estudio de este concepto en la exploración del planeta Marte, en el cual se intentó conocer el nivel del mar durante misiones que se llevaron a cabo en la década de los años 1970.
Punto triple del agua
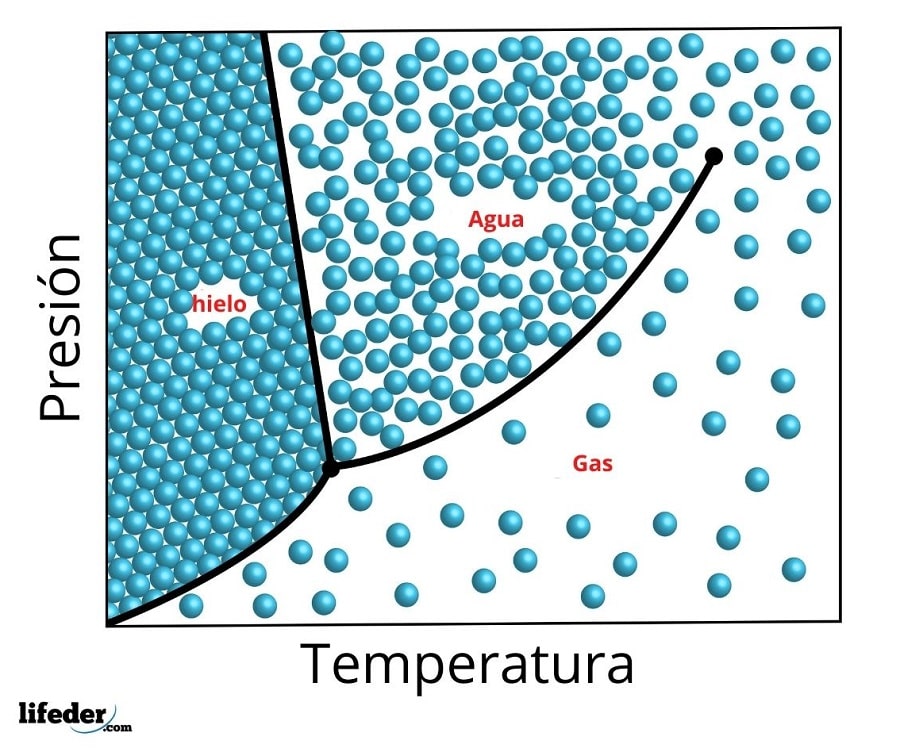
Las condiciones precisas de presión y temperatura a las que coexiste el agua en sus tres fases en equilibrio —agua líquida, hielo y vapor— ocurren a una temperatura de exactamente 273,16 K (0,01 ºC) y una presión parcial de vapor de 611,656 pascales (0,00603659 atm).
En este punto es posible la conversión de la sustancia a cualquiera de las tres fases con mínimos cambios en su temperatura o presión. Aun cuando la presión total del sistema podría ubicarse por encima de la requerida para el punto triple, si la presión parcial de vapor se encuentra a 611,656 Pa, el sistema llegará de igual forma al punto triple.
Es posible observar en la figura anterior la representación del punto triple (o triple point, en inglés) de una sustancia cuyo diagrama es similar al del agua, de acuerdo con la temperatura y presión requerida para alcanzar este valor.
En el caso del agua, este punto corresponde a la presión mínima a la cual el agua líquida puede existir. A presiones menores a este punto triple (por ejemplo, en el vacío) y cuando se utilice un calentamiento a presión constante, el hielo sólido se convertirá directamente a vapor de agua sin pasar por líquido; este es un proceso llamado sublimación.
Más allá de esta presión mínima (Ptp), el hielo primero se derretirá para formar agua líquida, y solo ahí evaporará o hervirá para formar vapor.
Para muchas sustancias el valor de temperatura en su punto triple es la mínima temperatura a la cual la fase líquida puede existir, pero esto no ocurre en el caso del agua. Para el agua esto no sucede, ya que el punto de fusión del hielo decrece en función a la presión, como se muestra con la línea punteada verde de la figura anterior.
En fases de alta presión el agua posee un diagrama de fases bastante complejo, en el cual se muestran quince fases de hielo conocidas (a distintas temperaturas y presiones), además de diez puntos triples distintos que se visualizan en la siguiente figura:
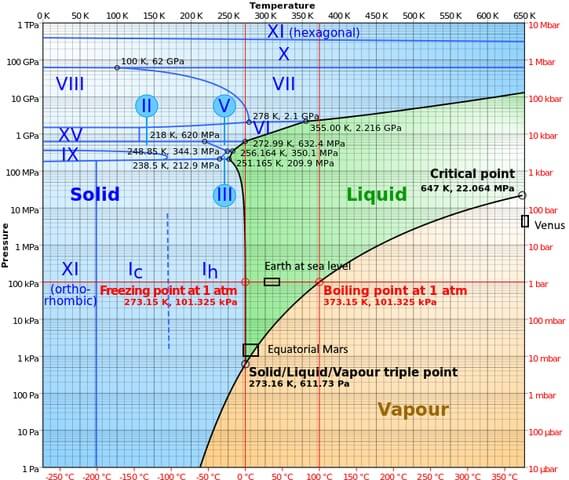
Se puede notar que, en condiciones de alta presión, el hielo puede existir en equilibrio con el líquido; el diagrama demuestra que los puntos de fusión incrementan con la presión. A bajas temperaturas constantes y haciendo incremento de presión, el vapor puede transformarse directamente a hielo, sin pasar por la fase líquida.
También se representan en este diagrama las condiciones distintas que ocurren en los planetas donde se ha estudiado el punto triple (Tierra a nivel del mar y en la zona ecuatorial de Marte).
El diagrama deja claro que el punto triple varía dependiendo de la ubicación por razones de presión y temperatura atmosféricas, y no solo por intervención del experimentador.
Punto triple del ciclohexano
El ciclohexano es un cicloalcano que posee la fórmula molecular de C6H12. Esta sustancia tiene la peculiaridad de poseer condiciones de punto triple que se pueden reproducir con facilidad, como en el caso del agua, ya que este punto se ubica a una temperatura de 279,47 K y una presión de 5,388 kPa.
En estas condiciones se ha observado al compuesto hirviendo, solidificando y derritiendo con mínimos cambios de temperatura y presión.
Punto triple del benceno
En un caso similar al ciclohexano, el benceno (compuesto orgánico con la fórmula química C6H6) posee condiciones de triple punto fácilmente reproducibles en un laboratorio.
Sus valores son 278,5 K y 4,83 kPa, por lo que también es común la experimentación con este componente a nivel de principiante.
Referencias
- Wikipedia. (s.f.). Wikipedia. Obtenido de en.wikipedia.org
- Britannica, E. (1998). Encyclopedia Britannica. Obtenido de britannica.com
- Power, N. (s.f.). Nuclear Power. Obtenido de nuclear-power.net
- Wagner, W., Saul, A., & Prub, A. (1992). International Equations for the Pressure along the Melting and along the Sublimation Curve of Ordinary Water. Bochum.
- Penoncello, S. G., Jacobsen, R. T., & Goodwin, A. R. (1995). A Thermodynamic Property Formulation for Cyclohexane.
