Celda galvánica: partes, como funciona, aplicaciones, ejemplos
La celda galvánica o celda voltaica es un tipo de celda electroquímica que consta de dos metales diferentes inmersos en dos semiceldas, en las que un compuesto en solución activa una reacción espontánea.
Entonces, uno de los metales en una de las semiceldas se oxida mientras el metal de la otra semicelda se reduce, produciendo un intercambio de electrones a través de un circuito externo. Esto permite aprovechar la corriente eléctrica.
El nombre de “celda galvánica” es en honor a uno de los pioneros de la experimentación con la electricidad: el médico y fisiólogo italiano Luigi Galvani (1737-1798).
Galvani descubrió en 1780 que si se unían por un extremo cables de metales diferentes y los extremos libres se ponían en contacto con el anca de una rana (muerta), entonces se producía una contracción.
Sin embargo, el primero en construir una celda electroquímica para producir electricidad fue el también italiano Alessandro Volta (1745-1827) en 1800 y de allí el nombre alternativo de celda voltaica.
Partes de la celda galvánica
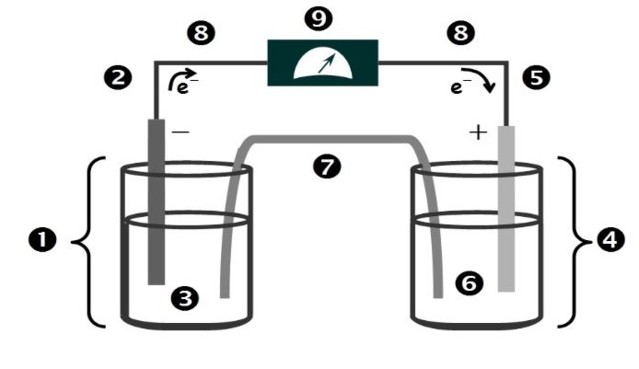
Las partes de una celda galvánica se muestran en la figura 1 y son las siguientes:
1.- Semicelda anódica
2.- Electrodo anódico
3.- Solución anódica
4.- Semicelda catódica
5.- Electrodo catódico
6.- Solución catódica
7.- Puente salino
8.- Conductor metálico
9.- Voltímetro
Funcionamiento
Para explicar el funcionamiento de una celda galvánica nos apoyaremos en la inferior:
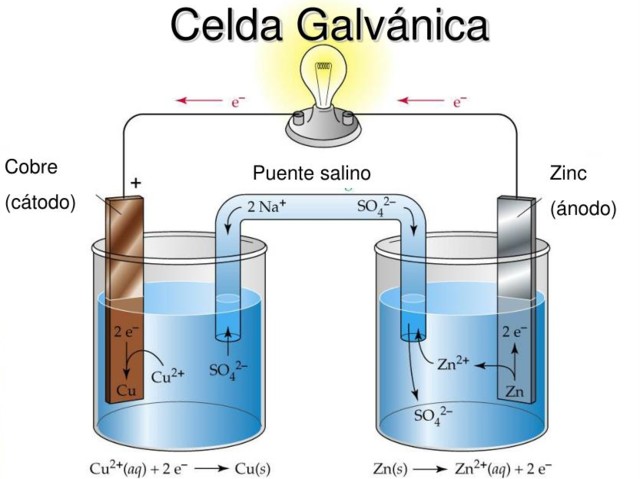
La idea fundamental de una celda galvánica es que el metal que sufre la reacción de oxidación quede separado físicamente del metal que se reduce, de modo tal que el intercambio de electrones ocurre a través de un conductor externo que permite aprovechar el flujo de corriente eléctrica, por ejemplo para encender una bombilla o led.
En la figura 2 en la semicelda de la izquierda se tiene una cinta de cobre (Cu) metálico inmersa en una solución de sulfato de cobre (CuS04), mientras que en la semicelda derecha se tiene una cinta de zinc (Zn) inmersa en una solución de sulfato de zinc (ZnSO4).
Debe notarse que en cada semicelda el metal de cada una está presente en dos estados de oxidación: los átomos neutros de metal y los iones metálicos de la sal del mismo metal en disolución.
Si las cintas metálicas no están unidas mediante un cable conductor exterior, entonces ambos metales se oxidan por separado en sus respectivas celdas.
Sin embargo, al estar conectadas eléctricamente ocurre que en el Zn se producirá oxidación mientras que en el Cu habrá una reacción de reducción. Esto se debe a que el grado de oxidación del zinc es mayor que el del cobre.
El metal que se oxida cede electrones al metal que se reduce a través del conductor exterior y este flujo de corriente puede aprovecharse.
Reacciones de oxidación y reducción
La reacción que ocurre en el lado derecho entre el electrodo metálico de zinc y la solución acuosa de sulfato de zinc es la siguiente:
Zno(s) + Zn2+ (SO4)2- → 2 Zn2+(ac) + (SO4)2- + 2 e–
Un átomo de zinc (sólido) en la superficie del electrodo anódico en la semicelda de la derecha, estimulado por los iones positivos del zinc en solución, cede dos electrones y se desprende del electrodo, pasando a la solución acuosa como un ión doble positivo de zinc.
Nos percatamos que el resultado neto fue que un átomo de zinc neutro del metal, mediante la pérdida de dos electrones, pasó a ser un ion de zinc que se suma a la solución acuosa, de modo que la barra de zinc perdió un átomo y la solución adquirió un ión doble positivo.
Los electrones liberados preferirán moverse por el cable externo hacia el metal de la otra semicelda con carga positiva (cátodo +). La barra de zinc va perdiendo masa ya que sus átomos pasan gradualmente a la solución acuosa.
La oxidación del zinc puede resumirse así:
Zno(s) → Zn2+(ac) + 2 e–
La reacción que ocurre en el lado izquierdo es similar, pero el cobre de la solución acuosa capta dos electrones (provenientes de la otra semicelda) y se deposita en el electrodo de cobre. Cuando un átomo capta electrones se dice que se reduce.
La reacción de reducción del cobre se escribe así:
Cu2+(ac) + 2 e– → Cuo(s)
La barra de cobre va ganando masa, ya que los iones de la solución pasan a la barra.
La oxidación se produce en el ánodo (negativo), el cual repele los electrones, mientras la reducción ocurre en el cátodo (positivo), que atrae a los electrones. El intercambio de electrones se produce a través del conductor externo.
El puente salino
El puente salino equilibra las cargas que se van acumulando en las dos semiceldas. En la semicelda anódica se acumulan iones positivos, mientras que en la catódica va quedando un exceso de iones negativos de sulfato.
Para el puente salino se usa una solución de una sal (como cloruro de sodio o cloruro de potasio) que no intervenga en la reacción, la cual está en un tubo en forma de U invertida con sus extremos taponados con una pared de material poroso.
La única finalidad del puente salino es que los iones se filtren hacia cada celda equilibrando o neutralizando el exceso de carga. De este modo a través del puente salino se produce un flujo de corriente, a través de los iones salinos, que cierra el circuito eléctrico.
Potenciales de oxidación y reducción
Se entiende por potenciales estándar de oxidación y reducción a los que se producen en ánodo y cátodo a la temperatura de 25ºC y con soluciones de concentración 1M (uno molar).
Para el zinc su potencial estándar de oxidación es Eox = +0,76 V. Mientras, el potencial estándar de reducción para el cobre es Ered = +0,34 V. La fuerza electromotriz (fem) producida por esta celda galvánica es: fem = +0,76 V + 0,34 V = 1,1 V.
La reacción global de la celda galvánica puede escribirse así:
Zno(s) + Cu2+(ac) → Zn2+(ac) + Cuo(s)
Tomando en cuenta al sulfato la reacción neta es:
Zno(s) + Cu2+ (SO4)2- 25ºC →Zn2+ (SO4)2-+ Cuo(s)
El sulfato es un espectador, mientras los metales intercambian electrones.
Representación simbólica de una celda galvánica
La celda galvánica de la figura 2, se representa simbólicamente de la siguiente manera:
Zno(s)|Zn2+(ac) (1M) || Cu2+(ac) (1M)|Cuo(s)
Por convención, a la izquierda se coloca siempre el metal que se oxida y forma el ánodo (-) y separado por una barra (|) su ión en estado acuoso. La semicelda anódica se separa de la catódica por dos barras (||) que representa al puente salino. A la derecha se coloca la semicelda del metal que se reduce y forma el cátodo (+).
En la representación simbólica de una celda galvánica el extremo izquierdo siempre es el metal que se oxida y en el extremo derecho se coloca el metal (en estado sólido) que se reduce. Debe advertirse que en la figura 2 las semiceldas están en posición inversa respecto de la representación simbólica convencional.
Aplicaciones
Conocidos los potenciales estándar de oxidación de diferentes metales es posible determinar la fuerza electromotriz que producirá una pila galvánica construida con estos metales.
En esta sección se aplicará lo expuesto en la secciones anteriores para calcular la fuerza electromotriz neta de una celda construida con otros metales.
Como ejemplo de aplicación consideramos una celda galvánica de hierro (Fe) y cobre (Cu). Como dato se dan las siguientes reacciones de reducción y su potencial estándar de reducción, es decir a 25ºC y concentración 1M:
Fe2+(ac) + 2 e– → Fe(s). E1red = -0,44 V
Cu2+(ac) + 2 e– → Cu(s). E2red = +0,34 V
Se pide hallar la fuerza electromotriz neta que produce la siguiente celda galvánica:
Fe(s)|Fe2+(ac)(1M)||Cu2+(ac)|Cu(s)
En esta pila el hierro se está oxidando y es el ánodo de la celda galvánica, mientras que el cobre se está reduciendo y es el cátodo. El potencial de oxidación del hierro es igual pero de signo contrario que su potencial de reducción, es decir E1oxd = +0,44.
Para obtener la fuerza electromotriz producida por esta celda galvánica, sumamos el potencial de oxidación de hierro con el potencial de reducción del cobre:
fem = E1oxd + E2red = -E1red + E2red = 0,44 V + 0,34 V = 0,78 V.
La celda galvánica en la vida diaria
Las celdas galvánicas de uso cotidiano distan mucho en forma de la que se usa como modelo didáctico, pero su principio de funcionamiento es el mismo.
La celda de uso más común es la pila alcalina de 1,5V en sus diferentes presentaciones. El nombre de pila viene porque se trata de un conjunto de celdas conectadas en serie con el fin de aumentar la fem.
Las baterías recargables de litio también se basan en el mismo principio de funcionamiento de las celdas galvánicas y son las que se usan en los teléfonos inteligentes, relojes y otros dispositivos.
De la misma forma las baterías de plomo de los automóviles, motos y lanchas son de 12V y se basan en el mismo principio de funcionamiento de la celda galvánica.
Las celdas galvánicas se usan en estética y en la regeneración muscular. Hay tratamientos faciales que consisten en aplicar corriente mediante dos electrodos en forma de rodillo o esfera que limpian y tonifican la piel.
También se aplican pulsos de corriente para regenerar la musculatura en personas que están en estado de postración.
Construcción de una celda galvánica casera
Hay muchas maneras de construir una celda galvánica casera. Una de las más sencillas es usando vinagre como solución, clavos de acero y cables de cobre.
Materiales
-Vasos plásticos desechables
-Vinagre blanco
-Dos tornillos de acero
-Dos trozos de alambre de cobre desnudo (sin aislante o barniz)
-Un voltímetro
Procedimiento
-Llenar ¾ partes del vaso con vinagre.
-Unir los dos tornillos de acero con varias vueltas de alambre, dejando un trozo de alambre sin enrollar.
El extremo sin enrollar de el cable de cobre se dobla en forma de U invertida, de manera tal que se apoye en el borde del vaso y los tornillos queden sumergidos en el vinagre.

Otro trozo de cable de cobre se dobla igualmente en U invertida y se cuelga en el borde del vaso en posición diametralmente opuesta al los tornillos sumergidos, de modo que una porción del cobre quede dentro del vinagre y la otra porción de cable de cobre por fuera del vaso.
Se conectan los extremos libres de los cables del voltímetro para medir la fuerza electromotriz producida por esta sencilla celda. La fem de este tipo de celdas es de 0,5V. Para igualar la fem de una pila alcalina se requiere construir dos celdas más y unir las tres en serie, de modo que se obtenga una pila de 1,5V
Referencias
- Borneo, R. Celdas galvánicas y electrolíticas. Recuperado de: clasesdequimica.blogspot.com
- Cedrón, J. Química general. PUCP. Recuperado de: corinto.pucp.edu.pe
- Farrera, L. Introducción a la electroquímica. Departamento de Fisicoquímica UNAM. Recuperado de: depa.fquim.unam.mx.
- Wikipedia. Celda electroquímica. Recuperado de: es.wikipedia.com.
- Wikipedia. Celda galvánica. Recuperado de: es.wikipedia.com.
