Anisol: estructura, propiedades, nomenclatura, riesgos y usos
El anisol o metoxibenceno es un compuesto orgánico que consiste de un éter aromático cuya fórmula química es C6H5OCH3. Su estado físico es el de un líquido incoloro, el cual puede presentar coloraciones amarillentas. Se reconoce fácilmente por su olor característico a anís.
Se trata entonces de un compuesto volátil y de fuerzas de cohesión no muy altas; características usuales en éteres livianos, los cuales se almacenan en pequeños recipientes sellados. Específicamente, el anisol es el más simple de los éteres arilo alquilo; es decir, aquellos con un componente aromático (Ar) y otro alquílico (R), Ar-O-R.
El grupo C6H5– viene a denotar a Ar, y -CH3 a R, teniendo así C6H5-O-CH3. El anillo aromático, y la presencia de -OCH3 como un grupo sustituyente llamado metoxi, le confiere al anisol una nucleofilicidad superior a la del benceno y nitrobenceno. Por lo tanto, sirve como molécula intermediaria para la síntesis de compuestos con actividad farmacológica.
Su olor característico a anís se ha utilizado para adicionar el anisol a productos cosméticos y de higiene que demanden una agradable fragancia.
Índice del artículo
- 1 Estructura del anisol
- 2 Propiedades
- 2.1 Apariencia física
- 2.2 Olor
- 2.3 Sabor
- 2.4 Masa molecular
- 2.5 Densidad
- 2.6 Densidad de vapor
- 2.7 Punto de fusión
- 2.8 Punto de ebullición
- 2.9 Punto de ignición
- 2.10 Temperatura de autoignición
- 2.11 Viscosidad
- 2.12 Tensión superficial
- 2.13 Índica de refracción
- 2.14 Solubilidad
- 2.15 Nucleofilicidad
- 2.16 Reactividad
- 3 Nomenclatura
- 4 Riesgos
- 5 Usos
- 6 Referencias
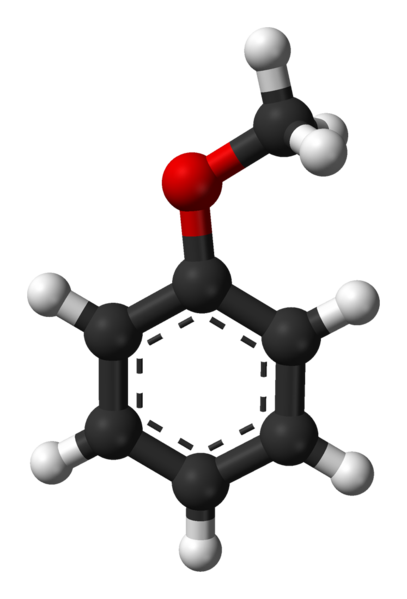
En la imagen superior se muestra la estructura molecular del anisol mediante un modelo de esferas y barras. Se aprecia el anillo aromático, cuyos carbonos son sp2 y por tanto es plano, como una lámina hexagonal; y enlazado a él, está el grupo metoxi, cuyo carbono es sp3, y sus hidrógenos están por encima o debajo del plano del anillo.
La importancia del grupo -OCH3 en la estructura va más allá que la de romper con la geometría plana de la molécula: le confiere polaridad, y en consecuencia, la molécula apolar de benceno adquiere un momento dipolar permanente.
Este momento dipolar se debe al átomo de oxígeno, el cual atrae las densidades electrónicas tanto del anillo aromático como del metilo. Gracias a ello, las moléculas de anisol pueden interactuar mediantes fuerzas dipolo-dipolo; aunque, carece de toda posibilidad de formar puentes de hidrógeno, por tratarse de un éter (ROR no tiene H enlazado al oxígeno).
Su elevado punto de ebullición (154ºC), certifica experimentalmente las fuertes interacciones intermoleculares que gobiernan su líquido. Asimismo, están presentes las fuerzas de dispersión de London, dependientes de la masa molecular, y las interacciones π-π entre los propios anillos.
La estructura del anisol, sin embargo, no le permite interaccionar con la suficiente fuerza para adoptar un sólido a temperatura ambiente (p.f = -37ºC). Esto puede deberse, además, a que al reducirse las distancias intermoleculares comiencen a cobrar mucha fuerza las repulsiones electrostáticas entre los electrones de anillos aromáticos vecinos.
Por lo tanto, y de acuerdo a estudios cristalográficos, las moléculas de anisol en cristales a una temperatura de -173ºC, no pueden ordenarse de tal manera que sus anillos queden enfrentados; esto es, sus centros aromáticos no se alinean uno encima del otro, sino que un grupo -OCH3 queda arriba o debajo de un anillo vecino.
Líquido incoloro pero que puede presentar leves tonalidades de color pajizo.
Huele ligeramente parecido a las semillas de anís.
Dulce; sin embargo, es moderadamente tóxico, por lo que esta prueba es peligrosa.
108,140 g/mol.
0,995 g/mL.
3,72 (en relación al aire = 1).
-37ºC.
154ºC.
125ºC (copa abierta).
475ºC.
0,778 cP a 30ºC.
34,15 dinas/cm a 30ºC.
1,5179 a 20ºC.
Pobremente soluble en agua (alrededor de 1mg/mL). En otros solventes, como la acetona, éteres y alcoholes, es sin embargo muy soluble.
El anillo aromático del anisol se encuentra rico en electrones. Esto se debe a que el oxígeno, pese a ser un átomo muy electronegativo, contribuye con los electrones de su nube π a deslocalizarlos por el anillo en numerosas estructuras de resonancias. En consecuencia, más electrones recorren el sistema aromático y aumenta por tanto su nucleofilicidad.
Experimentalmente se ha demostrado el incremento de la nucleofilicidad mediante la comparación de su reactividad, frente a las sustituciones electrofílicas aromáticas, con la del benceno. Así, se evidencia el notable efecto que posee el grupo -OCH3 sobre las propiedades químicas del compuesto.
Asimismo, cabe resaltar que las sustituciones electrofílicas ocurren en las posiciones adyacentes (-orto) y opuesta (-para) al grupo metoxi; esto es, se trata de orto-para director.
La nucleofilicidad del anillo aromático del anisol ya permite entrever cómo es su reactividad. Las sustituciones pueden ocurrir bien sea en el anillo (favorecido por su nucleofilicidad), o en el mismo grupo metoxi; en estas últimas se rompe el enlace O-CH3 para sustituir el -CH3 por otro grupo alquílico: O-alquilación.
Por lo tanto, en un proceso de alquilación el anisol puede aceptar un grupo R (fragmento de otra molécula) sustituyendo un H de su anillo (C-alquilación), o sustituyendo el CH3 de su grupo metoxi. La siguiente imagen ilustra lo recién dicho:
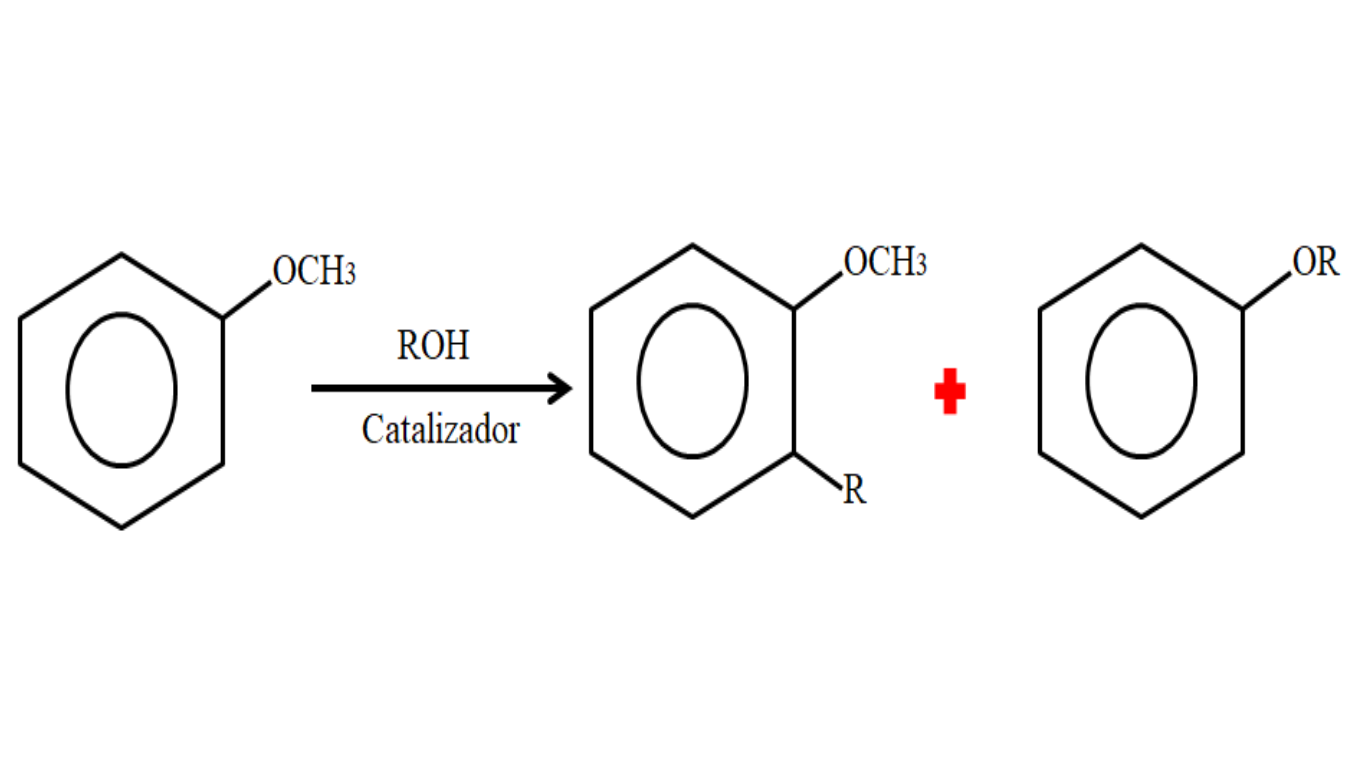
En la imagen el grupo R se ubica en posición -orto, pero puede también estar en la posición -para, opuesta al -OCH3. Cuando sucede la O-alquilación, se obtiene un nuevo éter con otro grupo -OR.
El nombre ‘anisol’ es el más conocido y aceptado, muy probablemente derivado de su olor parecido al anís. Sin embargo, el nombre ‘metoxibenceno’ es bastante específico, pues establece de una vez cuál es la estructura e identidad de este éter aromático; este es el nombre regido por la nomenclatura sistemática.
Otro nombre menos utilizado, pero igualmente válido, es el ‘fenil metil éter’, el cual se rige por la nomenclatura tradicional. Este quizás sea el nombre más específico de todos, ya que señala directamente cuáles son las dos porciones estructurales del éter: fénil-O-metil, C6H5-O-CH3.
Estudios médicos no han podido demostrar todavía los posibles efectos mortales del anisol en el organismo a bajas dosis. No obstante, como casi todas las sustancias químicas, produce irritaciones cuando se expone demasiado tiempo y en moderadas concentraciones a la piel, garganta, pulmones y ojos.
Asimismo, debido a la nucleofilicidad de su anillo, una parte de él se metaboliza y por lo tanto es biodegradable. De hecho, a raíz de esta propiedad simulaciones demostraron que no logra concentrarse en los ecosistemas acuosos ya que sus organismos primero lo degradan; y por ende, los ríos, lagos ni mares pueden acumular anisol.
En los suelos, dada su volatilidad, se evapora rápidamente y es arrastrado por las corrientes de aire; siendo así, tampoco afecta considerablemente las masas vegetales o plantaciones.
Por otro lado, atmosféricamente reacciona con los radicales libres, y por tanto no representa un riesgo de contaminación para el aire que respiramos.
A partir del anisol pueden obtenerse otros derivados mediante sustitución electrofílica aromática. Esto hace posible que se utilice como un intermediario para la síntesis de fármacos, pesticidas y solventes, a los cuales se les desea añadir sus características. Las rutas sintéticas pueden consistir de una C-alquilación u O-alquilación en su mayoría.
Además de su uso para síntesis orgánicas, puede emplearse directamente como aditivo para cremas, pomadas y perfumes, incorporándoles fragancias de aníes a tales productos.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. A. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- National Center for Biotechnology Information. (2019). Anisole. PubChem Database, CID=7519. Recuperado de: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Anisole. Recuperado de: en.wikipedia.org
- Pereira, Cynthia C. M., de la Cruz, Marcus H. C., & Lachter, Elizabeth R. (2010). Liquid phase alkylation of anisole and phenol catalyzed by niobium phosphate. Journal of the Brazilian Chemical Society, 21(2), 367-370. dx.doi.org/10.1590/S0103-50532010000200025
- Seidel R. W. y Goddard R. (2015). Anisole at 100 K: the first crystal structure determination. Acta Crystallogr C Struct Chem. Aug; 71(Pt 8):664-6. doi: 10.1107/S2053229615012553
- Formulación Química. (2018). Metoxibenceno. Recuperado de: formulacionquimica.com
