Estructura terciaria de las proteínas: características principales
La estructura terciaria de las proteínas es la conformación tridimensional que adquieren las cadenas polipeptídicas al plegarse sobre si mismas. Esta conformación aparece por interacciones entre las cadenas laterales de los residuos aminoácidos del polipéptido. Las cadenas laterales pueden interaccionar independientemente de su posición en la proteína.
Debido a que depende de las interacciones entre los grupos R, la estructura terciaria muestra aspectos no repetitivos de la cadena, pues estos grupos son diferentes para cada residuo aminoácido. La estructura secundaria, en cambio, depende de los grupos carboxilo y amino, que están presentes en todos los aminoácidos.
Algunos autores sugieren que las proteínas fibrosas poseen una estructura terciaria simple, pero sin embargo, otros autores señalan que esta estructura es propia de las proteínas globulares.
Índice del artículo
En las proteínas fibrosas, las cadenas polipeptídicas están dispuestas en forma de largos filamentos o largas láminas; generalmente están conformadas por un tipo único de estructura secundaria. Esta estructura secundaria es, en la mayoría de los casos, más importante que la estructura terciaria en la determinación de la forma de la proteína.
Su función biológica es estructural, confiriéndole fuerza y/o elasticidad a los órganos y estructuras donde se encuentran, a la vez que las mantienen unidas. Todas las proteínas fibrosas son insolubles en agua, debido a la gran cantidad de residuos aminoácidos hidrófobos que presentan.
Entre estas proteínas fibrosas se encuentran las queratinas y el colágeno. Las primeras se encuentran en tejidos conjuntivos y en estructuras como pelos, uñas (α-queratinas), escamas y plumas (β-queratinas). El colágeno, por su parte, se encuentra en huesos, tendones y piel, entre otros.
Estas proteínas forman parte de las denominadas proteínas de los filamentos intermedios, que juegan un papel importante en el citoesqueleto de organismos pluricelulares. Además, son el constituyente principal de pelos, uñas, lana, cuernos, pezuñas, y una de las principales proteínas de la piel animal.
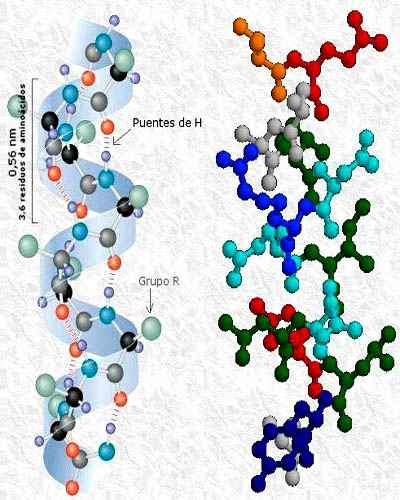
La estructura de la molécula es una hélice α. Dos hebras de α-queratina pueden disponerse en forma paralela y enrollarse una sobre otra con sus grupos R hidrófobos interaccionando entre ellos. De esta manera se crea una estructura superhelicoidal u ovillo con arrollamiento hacia la izquierda.
La estructura terciaria de la α queratina es simple y se encuentra dominada por la estructura secundaria de la α-hélice. Por otro lado, también está presente la estructura cuaternaria, puesto que participan dos moléculas en la estructura superhelicoidal, las cuales interaccionan por medio de enlaces no covalentes.
La estructura primaria es similar a la de las α-queratinas, pero su estructura secundaria está dominada por láminas β. Son constituyente principal de las escamas de los reptiles y las plumas de las aves.
Esta proteína puede llegar a representar más del 30% de la masa total de proteína de algunos animales. Se encuentra en cartílagos, huesos, tendones, la córnea y la piel, entre otros tejidos.
La estructura secundaria del colágeno es única, estando representada por una hélice levógira con 3,3 residuos aminoácidos por cada vuelta. Tres cadenas de hélice levógiras (cadenas α) se enrollan unas sobre otras dando una molécula superenrollada dextrógira, denominada por algunos autores como tropocolágeno.
Las moléculas de tropocolágeno se juntan para formar una fibra de colágeno que posee una gran resistencia, superior a la del acero y comparable con la del cobre de alta resistencia.
Otros tipos de proteínas fibrosas las constituyen la fibroína y la elastina. La primera de ellas está formada por láminas β, constituidas principalmente por glicina, alanina y serina.
Las cadenas laterales de estos aminoácidos son de pequeño tamaño, por lo cual pueden empaquetarse estrechamente. El resultado es una fibra que es a la vez muy resistente y muy poco extensible.
En la elastina, por su parte, la valina sustituye a la serina entre sus aminoácidos constituyentes principales. Al contrario de la fibroína, la elastina es muy extensible, de allí su nombre. En la constitución de la molécula, también actúa la lisina, que puede participar en entrecruzamientos que permiten a la elastina recuperar su forma al cesar la tensión.
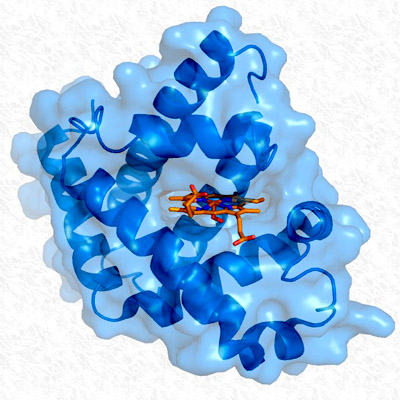
Las proteínas globulares, al contrario que las fibrosas, son solubles y generalmente presentan varios tipos de estructuras secundarias. Sin embargo, en estas son más importantes las conformaciones tridimensionales que adquieren al plegarse sobre sí mismas (estructura terciaria).
Estas conformaciones tridimensionales particulares le confieren actividad biológica específica a cada proteína. La principal función de estas proteínas es reguladora, tal como ocurre con las enzimas.
La estructura terciaria de las proteínas globulares posee algunas características importantes:
– Las proteínas globulares son compactas gracias al empaquetamiento al plegarse la cadena polipeptídica.
– Los residuos aminoácidos distantes en la estructura primaria de las cadenas polipeptídicas, quedan próximos, pudiendo interaccionar entre ellas a causa del plegado.
– Las proteínas globulares de mayor tamaño (de más de 200 aminoácidos) pueden poseer varios segmentos compactos, independientes entre ellos y con funciones particulares, y cada uno de estos segmentos recibe el nombre de dominio. Un dominio puede tener entre 50 y 350 residuos aminoácidos.
Como ya se señaló, las proteínas presentan formas particulares de plegado, que les confieren características también particulares. Este plegado no es aleatorio y se ve favorecido tanto por la estructura primaria y secundaria como por algunas interacciones no covalentes, e igualmente existen algunas restricciones físicas al plegado, por lo cual se han formulado algunas reglas:
– Todas las proteínas globulares poseen patrones de distribución definidos, con los grupos R hidrófobos dirigidos hacia el interior de la molécula y los residuos hidrófilos en la capa externa. Para ello se requieren al menos dos capas de estructura secundaria. El lazo β-α-β y el vértice α-α pueden aportar esas dos capas.
– Las láminas β se disponen generalmente en forma enrollada levógira.
– En una cadena polipéptida, pueden ocurrir diferentes giros para pasar de una estructura secundaria a otra, tales como los giros β o γ, que pueden lograr invertir la dirección de la cadena en cuatro residuos aminoácidos o menos.
– Las proteínas globulares poseen hélices α, láminas β, giros y segmentos estructurados irregularmente.
Si una proteína pierde su estructura tridimensional nativa (natural), pierde su actividad biológica y la mayoría de sus propiedades específicas. A este proceso se le conoce con el nombre de desnaturalización.
La desnaturalización puede ocurrir cuando cambian las condiciones ambientales naturales, por ejemplo al variar la temperatura o el pH. El proceso es irreversible en muchas proteínas; sin embargo, otras pueden recuperar espontáneamente su estructura natural al restablecerse las condiciones ambientales normales.
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biochemestry. 3th edition. Benjamin / Cummings Publishing Company, Inc.
- R.Murray, P. Mayes, D.C. Granner & V.W. Rodwell (1996). Harper’s Biochemestry. Appleton & Lange.
- J.M. Berg, J.L. Tymoczko & L. Stryer (2002). Biochemestry. 5th edition. W. H. Freeman and Company.
- W.M. Becker, L.J. Kleinsmith & J. Hardin (2006) World of the Cell. 6th Edition. Pearson Education Inc.
- A.Lehninger (1978). Bioquímica. Ediciones Omega, S.A.
- T. McKee & J.R. McKee (2003). Biochemistry: The molecular basis of life. 3rd edition. The McGraw-HiII Companies, Inc.