Agar XLD: fundamento, preparación y usos
El agar XLD o agar Xilosa Lisina Desoxicolato es un medio de cultivo sólido selectivo y diferencial para el aislamiento de enteropatógenos. Taylor diseñó la fórmula del agar XL (Xilosa, Lisina) con el fin de mejorar el aislamiento del género Shigella.
Observó que este género era inhibido en la mayoría de los medios destinados para el aislamiento de enteropatógenos. Posteriormente, se le adicionó desoxicolato sódico, tiosulfato de sodio y citrato amónico férrico para aumentar su selectividad. Esta fórmula ha resultado ser útil tanto para el aislamiento de Shigella, como de Salmonella.
El agar XLD está compuesto por extracto de levadura, desoxicolato de sodio, xilosa, lisina, lactosa, sacarosa, tiosulfato sódico, citrato férrico de amonio, cloruro sódico, rojo fenol y agar. En la mayoría de los laboratorios de bacteriología se usa el dúo agar XLD y agar SS para el estudio de muestras fecales en busca de Shigella y Salmonella.
Otros laboratorios prefieren la combinación de CHROMagar Salmonella y agar XLD, entre otras opciones disponibles. Estos dúos se pueden preparar en placas de Petri dobles. En un lado colocan agar XLD y en el lado opuesto el otro medio elegido.
Índice del artículo
El agar XLD cuenta con el extracto de levadura, que sirve como fuente de nutrientes a los microorganismos que se desarrollan en este agar. Además, la presencia de carbohidratos (xilosa, sacarosa y lactosa) proporcionan energía a las bacterias que pueden fermentarlas.
Como sustancia inhibidora presenta desoxicolato sódico; este impide el crecimiento de las bacterias Gram positivas, dándole el carácter selectivo al medio.
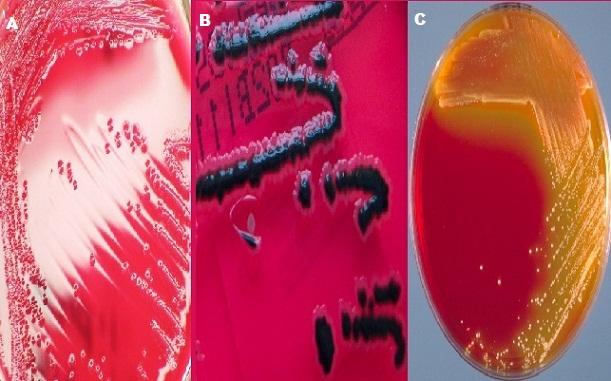
Colonias típicas de Shigella
Como ya se ha mencionado, el agar XLD contiene xilosa; este carbohidrato es fermentado por todas las bacterias que crecen en este medio a excepción del género Shigella.
Esta es una de las características que le brinda su carácter diferencial, ya que las colonias de Shigella se distinguen del resto por desarrollar colonias rojas, mientras que las demás bacterias producen colonias de color amarillo.
Colonias típicas de Salmonella
El género Salmonella también fermenta la xilosa, generando inicialmente colonias amarillas. Sin embargo, tras agotar al carbohidrato xilosa, ataca a la lisina por su enzima lisina descarboxilasa. La descarboxilación de la lisina genera álcalis que hacen virar el color de la colonia y al medio circundante a rojo original.
Este comportamiento solo es realizado por Salmonella, ya que los coliformes que descarboxilan la lisina no logran alcalinizar el medio. Esto es debido a que los coliformes también fermentan la lactosa y la sacarosa presente; por tanto, la producción de ácidos es muy alta, quedando la colonia amarilla en estas bacterias.
Cabe destacar que el género Salmonella no fermenta la sacarosa, ni la lactosa.
Producción de H2S
El agar XLD también permite detectar a las especies de Salmonella productoras de H2S; para ello cuenta con la fuente de sulfuro representado por el tiosulfato de sodio y un revelador de la reacción que es el citrato férrico de amonio.
Este último reacciona con el H2S (gas incoloro) y forma un precipitado negro visible insoluble de sulfato de hierro. En este sentido, las características de las colonias de salmonella serán rojas con un centro negro.
Cabe destacar que para que se dé la reacción de formación de H2S, se necesita un pH alcalino. Es por ello que otras enterobacterias que forman H2S no pueden hacerlo o lo hacen pobremente en este medio, pues la alta acidez que producen al fermentar los carbohidratos presentes inhiben o dificultan la reacción.
Finalmente, el cloruro de sodio mantiene el equilibrio osmótico; el agar es el agente solidificante y el rojo de fenol detecta los cambios de pH, haciendo virar el color de las colonias y del medio.
Pesar 55 gr de medio XLD deshidratado y disolver en 1 litro de agua. Calentar y agitar la mezcla hasta que llegue al punto de ebullición. No sobrecalentar, ya que el calor daña el medio y crea un precipitado que altera la morfología de las colonias típicas.
Este medio no debe autoclavarse. Al disolver se debe pasar a un baño de María a 50°C. Al enfriar se debe servir directamente sobre placas de Petri estériles. Pueden vertirse en placas sencillas o en placas dobles. Se dejan solidificar y se guardan en nevera hasta su uso.
Atemperar antes de usar. Como es un medio no esterilizado se recomienda prepararlo cercano a la fecha de su uso.
El pH final del medio debe quedar en 7,4 ± 0,2. El color del medio preparado es rojo naranja, traslúcido, sin precipitado.
Si se cuenta con el agar base Xilosa Lisina (XL) se le puede agregar desoxicolato de sodio, tiosulfato de sodio y citrato amónico de hierro. De esta manera se obtiene la fórmula del agar XLD.
El agar XLD se usa para la recuperación de enteropatógenos, principalmente del género Shigella y secundariamente del género Salmonella. Es útil para evaluar muestras de heces, agua y alimentos.
Heces
Las muestras de heces se pueden sembrar de forma directa en el agar XLD, realizando una buena distribución del material para obtener colonias aisladas.
Para mejorar la recuperación de Salmonella se puede sembrar el agar XLD a partir de medios de enriquecimiento para Salmonella.
Alimento
En el caso de alimentos se pueden usar caldos de enriquecimiento para Salmonella y para Shigella. Para Salmonella se puede utilizar caldo selenito cistina, caldo tetrationato verde brillante, entre otros.
En el caso de Shigella se puede enriquecer con el caldo Shigella con 0,5 µ/ml de novobiocina, incubado a 42°±1°C por 16-20 horas.
Agua
En los análisis de agua se recomienda la técnica de filtración con membrana y el uso de agar XLD, entre otros.
El medio sembrado se incuba en aerobiosis a 35°C por 24 a 48 horas.
Se observan las colonias típicas de cada género, a las colonias sospechosas se le deben realizar pruebas bioquímicas para su identificación.
Para evaluar el control de calidad del medio se pueden usar las siguientes cepas bacterianas: Salmonella typhimurium ATCC 14028, Salmonella enteritidis ATCC 13076, Salmonella abony DSM 4224, Shigella flexneri ATCC 12022, Shigella sonnei ATCC 25931, Escherichia coli ATCC 25922, Proteus mirabilis ATCC 43071, Klebsiella pneumoniae ATCC 33495.
El género Salmonella se caracteriza por presentar en este medio colonias rojas con centro negro o colonias completamente negras. En tanto que, en el género Shigella las colonias deben ser rojas, es decir del color del medio.
En el caso de Escherichia coli se espera que sea inhibida total o parcialmente; si crece las colonias son amarillas. Para Proteus mirabilis se espera un crecimiento escaso con colonias rosadas con o sin centro negro. Finalmente, el género Klebsiella crecerá como colonias amarillas.
El agar XLD es muy empleado en los laboratorios de bacteriología por su alta eficiencia para la recuperación de Shigella y además posee una buena recuperación del género Salmonella.
Rall y colaboradores (2005) en su trabajo titulado “Evaluación de tres caldos de enriquecimiento y cinco medios sólidos para la detección de Salmonella en aves de corral” demostraron que de los 3 medios clásicos probados (agar verde brillante, agar SS y agar XLD), el agar XLD obtuvo la mejor tasa de recuperación.
Los porcentajes de recuperación fueron los siguientes: 13.8% para agar verde brillante, 27.6% para SS, y 34.5% para XLD. Solo fue superado por los medios cromogénicos agar Rambach con 48% de recuperación y el CHROMagar con 79.3%.
- Enfermedades trasmitidas por alimentos. Shigellosis. Disponible en: anmat.gov.ar
- “Agar XLD.” Wikipedia, La enciclopedia libre. 9 feb 2019, 11:46 UTC. 10 abr 2019, 19:25 wikipedia.org
- BBL Laboratorios. CHROMagar Salmonella / Agar XLD de BD (biplaca).2013 Disponible en: bd.com
- Lab. Neogen. Agar XLD. Disponible en: foodsafety.neogen
- Laboratorio Francisco Soria Melguizo. XLD Agar. Disponible en: http://f-soria.es/Inform
- Rall L, Rall R, Aragon C, Silva M. Evaluation of three enrichment broths and five plating media for Salmonella detection in poultry. Braz. J. Microbiol. 2005; 36 ( 2 ): 147-150. Available from: scielo.br
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnóstico Microbiológico de Bailey & Scott. 12 ed. Editorial Panamericana S.A. Argentina.
