Reacción de Fehling: preparaciones, agentes activos, ejemplos, usos
La reacción de Fehling o test de Fehling es un método que permite detectar y, hasta cierto punto, cuantificar los azúcares reductores de una muestra. Sus propiedades químicas son muy similares a las de la reacción de Benedict, diferenciándose únicamente en el complejo de cobre que participa en la oxidación de los azúcares.
También se utiliza el test de Fehling para discernir entre un aldehído y una cetona; sin embargo, las alfa-hidroxicetona dan una respuesta positiva, como es el caso de los monosacáridos cetosas. Así pues, las aldosas (monosacáridos aldehídos) y cetosas, componiendo los azúcares reductores, se oxidan a sus respectivas formas ácidas.

En la imagen superior se muestra el reactivo de Fehling en el tubo de ensayo de la izquierda. Su color azulado se debe al CuSO4·5H2O disuelto en agua, cuyos iones de cobre se acomplejan con los aniones tartratos evitando que precipite el hidróxido de cobre en medio alcalino.
Una vez transcurrida la reacción en un baño caliente a 60 ºC y ante la presencia de aldehídos o azúcares reductores, se forma un precipitado pardo, indicativo de una prueba positiva.
Este precipitado es el óxido cuproso, Cu2O, el cual puede pesarse para así determinar cuántos azúcares reductores o aldehídos había en la muestra.
Índice del artículo
- 1 Preparación del reactivo de Fehling
- 2 Agente activo
- 3 Ecuación química
- 4 Usos y ejemplos
- 5 Referencias
El reactivo de Fehling en realidad consiste de una mezcla de dos soluciones, A y B, en la cual se forma el complejo bistartratocuprato(II); este es, el verdadero agente activo.
La solución A de Fehling es una disolución acuosa de CuSO4·5H2O, a la cual puede añadírsele una pequeña cantidad de ácido sulfúrico para ayudar a disolver los cristales azulados. Dependiendo de los volúmenes que se necesiten, se disuelven 7 g o 34,65 g de la sal de cobre, se trasvasan a un balón aforado 100 mL o 400 mL, respectivamente, y se enrasa con agua destilada.
Esta solución es de color azul claro, y contiene los iones Cu2+, los cuales serán las especies reducidas cuando tome lugar la reacción de Fehling.
La solución B de Fehling es una disolución fuertemente alcalina de tartrato de sodio y potasio, conocido también como la sal de La Rochelle, en hidróxido de sodio.
La fórmula de esta sal es KNaC4H4O6·4H2O, pudiéndose escribir como HO2CCH(OH)CH(OH)CO2H, y se disuelven 35 g de la misma en 12 g de NaOH enrasando con 100 mL de agua destilada. O si se cuenta con más cantidades de sal de La Rochelle, se pesan 173 g y se disuelven en 400 mL de agua destilada con 125 g de NaOH, enrasando hasta 500 mL con agua destilada.
El propósito de que el medio sea fuertemente alcalino es el de desprotonar los grupos hidroxilos centrales OH del tartrato, para que así sus átomos de oxígeno puedan coordinarse con los Cu2+ y establecer el complejo bistartratocuprato (II). Este complejo, de color azul más oscuro, se forma cuando se mezclan volúmenes iguales de las soluciones A y B.
Hecho esto, se toma una alícuota de 2 mL y se transfiere a un tubo de ensayo, al cual se le añadirá 3 gotas de la muestra que queremos averiguar si tiene un aldehído o azúcar reductor. Luego y finalmente, el tubo de ensayo debidamente sostenido se introduce en un baño de agua caliente a 60 ºC, y se aguarda por la aparición de un precipitado pardo indicativo de una prueba positiva.
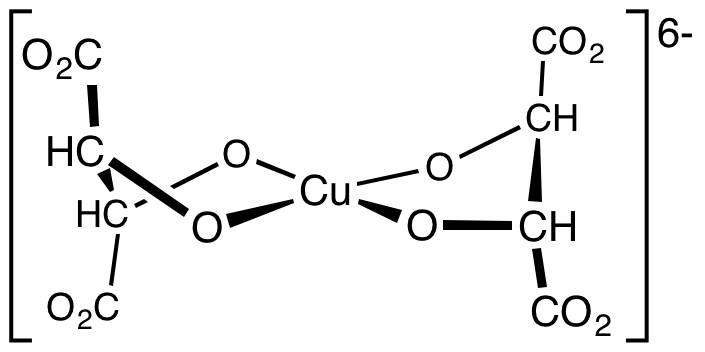
En la imagen superior tenemos la fórmula estructural del complejo bistartratocuprato (II). Cada ion Cu2+ de la solución A se acompleja con dos tartratos provenientes de la solución B, impidiendo que precipite el hidróxido de cobre por la presencia de los iones OH– del medio.
Este complejo pudiera escribirse como Cu(C4H4O6)22−. ¿Por qué ha cambiado la carga negativa de -6 a -2? Esto se debe a que en la imagen no se consideran los iones circundantes K+ ni Na+, los cuales neutralizan las cargas negativas de los grupos carboxilatos, -CO2–, de los extremos del complejo.
Así, el Cu(C4H4O6)26− al rodearse de dos pares de K+ y Na+, su carga queda como Cu(C4H4O6)22−, donde en el centro del complejo tenemos al Cu2+.
¿Cuál es la reacción que toma lugar cuando este complejo entra en contacto con un aldehído, una aldosa o una cetosa? Las cetosas en su conformación cíclica, se oxida su carbono anomérico C-OH a CHO: una aldosa, la cual luego esta continúa oxidándose a su forma ácida, COOH.
La siguiente ecuación química muestra la oxidación de los aldehídos a ácidos carboxílicos:
RCHO + 2 Cu(C4H4O6)22− + 5 OH− → RCOO− + Cu2O + 4 C4H4O62− + 3 H2O
Pero, debido a que el medio es fuertemente alcalino, tenemos RCOO– y no RCOOH.
El aldehído, aldosa, o cetosa oxidada, RCHO, se oxida ya que adquiere un enlace extra con el oxígeno. Por otro lado, los iones Cu2+ se reducen a Cu+ (Cu2+O2-), siendo la especie reducida. Al reaccionar el complejo y formarse el precipitado rojo de Cu2O, los iones tartratos se liberan y quedan libres en el medio.
Cuando se sospecha de la presencia de un aldehído o una cetona, la prueba positiva del reactivo de Fehling indica que se trata de un aldehído. Esto suele ser de mucha utilidad en pruebas cualitativas orgánicas. Cualquier aldehído, siempre que sea alifático y no aromático, reaccionará y veremos el precipitado rojo de Cu2O.
La reacción de Fehling permite cuantificar la cantidad de azúcares reductores en la muestra al pesarse el Cu2O. Sin embargo, no es de utilidad para discernir entre una aldosa o cetosa, ya que ambas dan resultados positivos. La sacarosa es uno de los pocos azúcares que arroja un resultado negativo, permaneciendo azulada la solución.
La glucosa, fructosa, maltosa, galactosa, lactosa y celobiosa, por ser azúcares reductores, responden positivamente al reactivo de Fehling; y por lo tanto, gracias a este método se les puede detectar y cuantificar. Por ejemplo, la cantidad de glucosa en la sangre y orina se ha cuantificado mediante el reactivo de Fehling.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison, R. T. y Boyd, R. N. (1990). Química Orgánica. (5ta edición). Editorial Addison-Wesley Iberoamericana.
- Wikipedia. (2020). Fehling’s solution. Recuperado de: en.wikipedia.org
- Sullivan Randy. (2012). Fehling Test. University of Oregon. Recuperado de: chemdemos.uoregon.edu
- Robert John Lancashire. (04 de enero de 2015). Fehling’s Test. Recuperado de: chem.uwimona.edu.jm
