Tecnecio (Tc): estructura, propiedades, usos, obtención
El tecnecio (Tc) es un elemento químico del grupo VII de la Tabla Periódica. Su número atómico es 43. Su nombre deriva de la palabra griega “tekhnetos”, que significa artificial, y se le asignó porque en el momento en que fue descubierto había sido creado artificialmente. Hoy en día se sabe que se encuentra naturalmente en la corteza terrestre aunque solo en cantidades ínfimas.
Es un metal radioactivo. Posee muchos isótopos, que son átomos de tecnecio con diferentes cantidades de neutrones en el núcleo. Ocupan el mismo lugar en la tabla periódica pero tienen masas atómicas diferentes.

Todos sus isótopos tienen una vida corta comparada a la de la Tierra, por lo que el tecnecio generado cuando se formó el planeta ha decaído casi todo desde hace mucho tiempo.
El más importante de los isótopos es el tecnecio-99m, el cual es utilizado ampliamente en medicina nuclear para el diagnóstico de diversas enfermedades.
El tecnecio se produce en los reactores nucleares. También se ha detectado su presencia en la materia estelar.
Índice del artículo
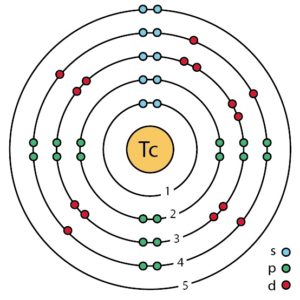
Su configuración electrónica es:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d5 5s2,
o también:
[Kr] 4d5 5s2.
A continuación se muestra un modelo de Bohr del átomo de tecnecio donde se pueden apreciar los diferentes orbitales con sus electrones alrededor del núcleo.
Cristaliza en un arreglo o red hexagonal compacta.
- Tecnecio, símbolo: Tc
- 99Tcm, 99mTc, Tecnecio-99m: diversas formas de indicar al isótopo metaestable del tecnecio con masa atómica 99
- Tecnecio-95m: isótopo metaestable con masa atómica 95
Sólido metálico con brillo plateado.

98
2157 ºC
4262 ºC
11 g/cm3
Se disuelve en ácido nítrico (HNO3), en agua regia (que es una mezcla de HNO3 concentrado y HCl concentrado) y en ácido sulfúrico concentrado (H2SO4). Es insoluble en ácido clorhídrico (HCl) o fluorhídrico (HF).
Los estados de oxidación que adopta este elemento son +4, +5 y +7. El tecnecio pierde su brillo metálico lentamente cuando se expone al aire húmedo, pues se produce un oxoácido.
Se quema en oxígeno por encima de 400 °C para dar el óxido Tc2O7 el cual sublima (pasa de sólido a gas directamente). No reacciona con peróxido de hidrógeno (H2O2).
El tecnecio posee 22 isótopos. Los isótopos son átomos del mismo elemento que poseen diferentes cantidades de neutrones en el núcleo, por lo que tienen masas distintas. Todos son radiactivos, por lo tanto, inestables, y poseen masas atómicas entre 90 y 111.
Los isótopos con vidas medias más largas son: 97Tc cuya vida media es de 4,2×106 años, 98Tc con vida media de 6,6×106 años, y 99Tc de 2,1×105 años. La vida media es el tiempo promedio que tarda el isótopo radiactivo en desintegrarse.

Aunque este elemento no tiene ninguna función bioquímica en los seres vivos, tiene la habilidad de unirse químicamente a muchas moléculas biológicamente activas.
Fue el primer elemento producido de manera artificial. Su existencia había sido predicha por el químico ruso Dmitri Mendeléyev en el siglo XIX, quien le asignó su actual lugar en la Tabla Periódica.
No fue sino hasta 1937 que se descubrió en una muestra de molibdeno que había sido bombardeada con neutrones en un laboratorio físico de Berkeley. Desde ese momento se comenzó a buscar en materiales terrestres.
En 1962 fue hallado en África en un mineral natural de uraninita, como producto de la fisión espontánea del uranio-238. Su concentración en este tipo de roca es extremadamente pequeña.
Se ha detectado su presencia en algunos tipos de estrellas, lo que ha conducido a nuevas teorías sobre la producción de elementos pesados en la materia estelar.
Se forma artificialmente en los reactores nucleares a partir de la fisión del uranio. Se extrae de las varillas de combustible nuclear gastadas, en forma de un polvo gris.
Por cada tonelada de uranio se genera un miligramo de tecnecio. Actualmente hay cantidades muy grandes (toneladas) que se han acumulado a lo largo de los años.

El tecnecio-99m (donde “m” significa metaestable) es el isótopo que más se utiliza. Tiene una vida media de 6,01 horas. Se usa ampliamente para estudios de diagnóstico médico pues emite rayos gamma.
Utilizando sus combinaciones con otras sustancias químicas se inyecta en los pacientes que van a ser evaluados. Una vez introducido en el organismo es absorbido por ciertos órganos y los rayos gamma que emite permiten obtener imágenes de diversas partes del cuerpo.
Corazón
Cuando el tecnecio-99m se une al pirofosfato tiene la capacidad de adherirse a los depósitos de calcio de los músculos deteriorados del corazón lo que permite evaluar las lesiones causadas por un ataque cardíaco.
Arterias y venas
Si se combina con un compuesto de estaño se une a los glóbulos rojos de la sangre y sirve para hacer un mapa de los desórdenes del sistema circulatorio.
Bazo
Unido al azufre se acumula en el bazo y se puede obtener una clara imagen de dicho órgano.
A continuación se muestra un ejemplo del tipo de imágenes obtenidas gracias a los rayos gamma emitidos por el tecnecio-99m:
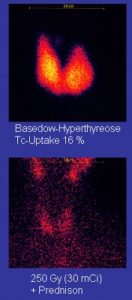
Huesos
El Tc-99m se utiliza para evaluar el grado de actividad de los osteoblastos en una lesión ósea. Los osteoblastos son las células del hueso que generan la matriz ósea.
Los escaneos o exploraciones con este isótopo son muy sensibles y permiten detectar metástasis (propagación de células cancerosas) y linfomas en los huesos (proliferación maligna de linfocitos en la médula ósea).
Cerebro
El dímero de etilcisteinato de 99mTc es absorbido fácilmente por el tejido del cerebro, lo que permite obtener imágenes de este órgano mediante tomografía computarizada de emisión monofotónica.
En forma de iones pertecnetato (TcO4–) actúa como inhibidor de corrosión para el acero, siendo excelente aún en cantidades muy pequeñas. Sin embargo, debe emplearse en sistemas cerrados debido a la radioactividad del tecnecio.
A la temperatura de 11 K (-262,15 °C) o inferiores se comporta como un superconductor sobresaliente.
El tecnecio-95m es un isótopo que tiene una vida media de 61 días y se usa como marcador o trazador radiactivo en ecología, por ejemplo para rastrear compuestos contaminantes y para estudiar el movimiento de las aguas superficiales.
Es un catalizador más efectivo que el renio (Re) o el paladio (Pd) en la reacción de deshidrogenación del alcohol isopropílico. Se ha propuesto también su utilización en baterías nucleares.
Pero su radioactividad es un problema para estos usos.
Es radioactivo, por lo tanto muy dañino para la salud de los seres vivos. Se estima que la exposición humana a este elemento se debe mayormente al uso del 99Tcm en medicina nuclear.

En tales casos, dicho isótopo, tras un tiempo, se deposita principalmente en la glándula tiroides y en el tracto gastrointestinal, pero según algunos estudios se elimina a través de la orina en pocos días.
Debido a que los reactores nucleares lo producen en grandes cantidades, el tecnecio es una carga adicional que se une a los desechos radioactivos no deseados en el planeta.
- Royal Society of Chemistry. (2020). Technetium. Recuperado de rsc.org.
- Lenntech B.V. (2020). Technetium – Tc. Recuperado de lenntech.com.
- Andersen, O. (2016). Decorporation of Radionuclides. Technetium. In Chelation Therapy in the Treatment of Metal Intoxication. Recuperado de sciencedirect.com.
- Lor Randall, R. (2010). Approach to the Diagnosis of Bone and Soft Tissue Tumors – Clinical, Radiologic, and Classification Aspects. In Bone and Soft Tissue Pathology. Recuperado de sciencedirect.com.
- Infeld, B. and Davis, S.M. (2004). Single-Photon Emission Computed Tomography. 99mTc-ECD SPECT. In Stroke (Fourth Edition). Recuperado de sciencedirect.com.
- Cotton, F. Albert and Wilkinson, Geoffrey. (1980). Advanced Inorganic Chemistry. Fourth Edition. John Wiley & Sons.
- Lide, D.R. (editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
