Quiralidad: qué es, definición, ejemplos
¿Qué es la quiralidad?
La quiralidad es una propiedad geométrica en la que un objeto puede tener dos imágenes: una derecha y otra izquierda, las cuales no son intercambiables. Es decir, son espacialmente diferentes, aun cuando el resto de sus propiedades sean idénticas. Un objeto que exhiba quiralidad se dice sencillamente que es ‘quiral’.
La mano derecha e izquierda son quirales: una es el reflejo (imagen especular) de la otra, pero no son iguales, ya que al poner una encima de la otra no coinciden sus dedos pulgares.
Más que un espejo, para saber si un objeto es quiral debe hacerse la siguiente pregunta: ¿tiene “versiones” tanto para el lado izquierdo como para el derecho?
Por ejemplo, un pupitre para zurdos y otro para diestros son objetos quirales. Dos vehículos del mismo modelo pero con el volante en la izquierda o la derecha, un par de zapatos, al igual que los pies. Escaleras de caracol en sentido izquierdo, y en sentido derecho, etc.
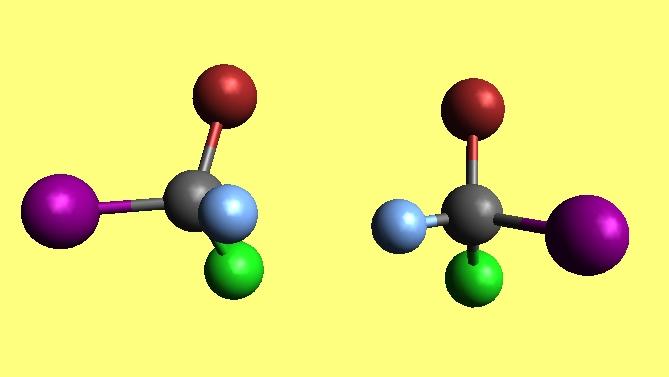
Y en la química las moléculas no son la excepción: también pueden ser quirales. En la imagen superior se muestra un par de moléculas con geometría tetraédrica.
Aunque se voltee la de la izquierda y se hagan tocar las esferas de color azul y morada, las de color marrón y verde “mirarán” fuera del plano.
¿Cómo determinar la quiralidad molecular?
Con las moléculas no es tan sencillo definir cuál es la “versión” izquierda o derecha con solo mirarlas.
Para esto, los químicos orgánicos recurren a las configuraciones (R) o (S) de Cahn-Ingold-Prelog, o se basan en la propiedad óptica de estas sustancias quirales de rotar la luz polarizada (la cual también es un elemento quiral).
Sin embargo, no es difícil determinar si una molécula o compuesto es quiral con solo observar su estructura. ¿Qué particularidad llamativa tiene el par de moléculas de la imagen superior?
Tiene cuatro sustituyentes diferentes, cada uno con su propio color característico, y además la geometría en torno al átomo central es tetraédrica.
Si en una estructura hay un átomo con cuatro sustituyentes diferentes, puede afirmarse (en la mayoría de los casos) que la molécula es quiral.
Entonces se dice que en la estructura hay un centro de quiralidad o centro estereogénico. Donde haya uno, habrá un par de estereoisómeros conocidos como enantiómeros.
Las dos moléculas de la imagen son enantiómeros. Mientras mayor sea el número de centros de quiralidad que posea un compuesto, mayor será su diversidad espacial.
El átomo central por lo general es un átomo de carbono en todas las biomoléculas y compuestos con actividad farmacológica. Sin embargo, puede ser también uno de fósforo, nitrógeno o un metal.
Ejemplos de quiralidad
El centro de quiralidad es quizás uno de los elementos más importantes a la hora de determinar si un compuesto es quiral o no.
No obstante, existen otros factores que pueden pasar desapercibidos, pero que, en modelos 3D, dejan en evidencia una imagen especular que no puede superponerse.
Para estas estructuras se dice entonces que en lugar de centro tienen otros elementos de quiralidad.
Con esto en mente, ya no basta con la presencia de un centro asimétrico con cuatro sustituyentes, sino que además debe analizarse cuidadosamente el resto de la estructura, y así ser capaz de diferenciar un estereoisómero de otro.
Axial
En la imagen superior se muestran compuestos que podrían parecer planos a simple vista, pero realmente no lo son.
A mano izquierda se tiene la estructura general de un aleno, donde R denota los cuatro sustituyentes diferentes. Y a mano derecha, la estructura general de un compuesto bifenilo.
El extremo donde se encuentran R3 y R4 podría visualizarse como una “aleta” perpendicular al plano donde yacen R1 y R2.
Si un observador analiza tales moléculas posicionando el ojo frente al primer carbono enlazado a R1 y R2 (para el aleno), verá a R1 y R2 a los lados izquierdo y derecho, y a R4 y R3 arriba y abajo.
Si R3 y R4 permanecen fijos, pero se cambian R1 a la derecha, y R2 a la izquierda, se tendrá entonces otra “versión espacial”.
Es aquí donde entonces el observador puede llegar a la conclusión de que encontró un eje de quiralidad para el aleno. Lo mismo ocurre con el bifenilo, pero con los anillos aromáticos de por medio en la visión.
Tornillos de anillos o helicidad
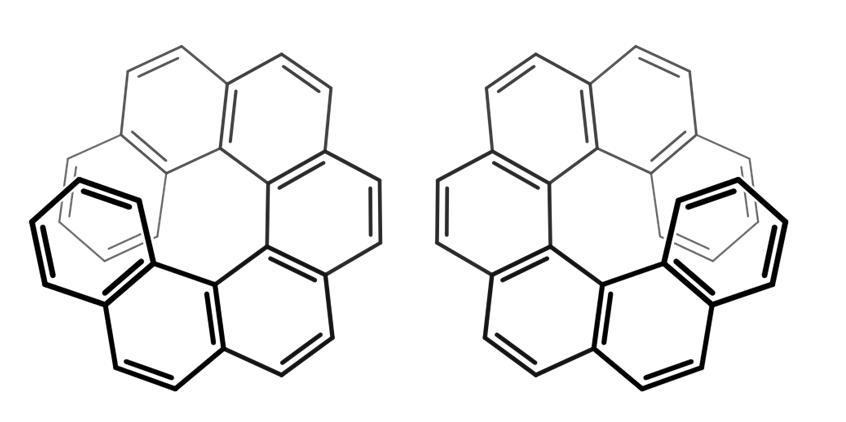
Nótese que en el ejemplo anterior el eje de quiralidad yacía en el esqueleto C=C=C, para el aleno, y en el enlace Ar-Ar, para el bifenilo.
Para los compuestos de arriba, llamados heptahelicenos (por tener siete anillos), su eje de quiralidad es el eje Z, el de la hélice.
Por lo tanto, para discernir de un enantiómero de otro, hay que observar estas moléculas desde arriba (preferiblemente).
De este modo, puede detallarse que un heptaheliceno gira en sentido de las agujas del reloj (lado izquierdo de la imagen), o en sentido antihorario (lado derecho de la imagen).
Planar
Supóngase que ya no se tiene un heliceno, sino una molécula con anillos no coplanares, esto es, uno se ubica por encima o debajo del otro (o no están en un mismo plano).
Aquí el carácter quiral no descansa tanto en el anillo, sino en sus sustituyentes, pues son estos los que definen cada uno de los dos enantiómeros.
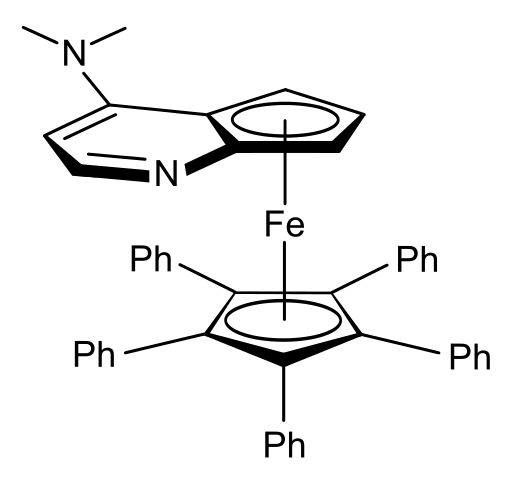
Por ejemplo, en el ferroceno de la imagen superior se tiene que los anillos que “emparedan” al átomo de Fe no cambian, pero sí la orientación espacial del anillo con el átomo de nitrógeno y el grupo -N(CH3)2.
En la imagen, el grupo -N(CH3)2 apunta hacia la izquierda, pero en su enantiómero apuntará hacia la derecha.
Otros
Para las macromoléculas o aquellas con estructuras singulares, empieza a simplificarse el panorama. Esto es porque a partir de sus modelos 3D puede verse a vuelo de pájaro si son quirales o no, tal como sucede con los objetos de los ejemplos iniciales.
Por ejemplo, un nanotubo de carbono puede mostrar patrones de giros hacia la izquierda, y, por lo tanto, es quiral si existe uno idéntico pero con giros hacia la derecha.
Lo mismo ocurre con otras estructuras donde, a pesar de no tener centros de quiralidad, la disposición espacial de todos sus átomos pueden adoptar formas quirales.
Se habla entonces de una quiralidad inherente, que no depende de un átomo sino de todo el conjunto.
Una forma químicamente contundente de diferenciar la “imagen izquierda” del de la derecha, es mediante una reacción estereoselectiva, es decir, aquella donde solamente pueda transcurrir con un enantiómero, mientras que con el otro no.
Referencias
- Chirality (chemistry). Recuperado de en.wikipedia.org
- Chirality. Recuperado de chemistryexplained.com
