Exudado nasal: para qué sirve, procedimiento, cultivo
El exudado nasal es un tipo de toma de muestra que sirve para el análisis citológico o microbiológico. En el examen citológico se busca la presencia de eosinófilos, entre otros tipos de células. Estas indican la posible etiología de los síntomas que presenta el paciente.
Por otro lado, el cultivo permite la identificación de la microbiota habitual, así como también de microorganismos colonizadores, tales como levaduras y Staphylococcus aureus. Por tanto, el cultivo del exudado nasal es la prueba ideal para detectar portadores nasales asintomáticos de Staphylococcus aureus.
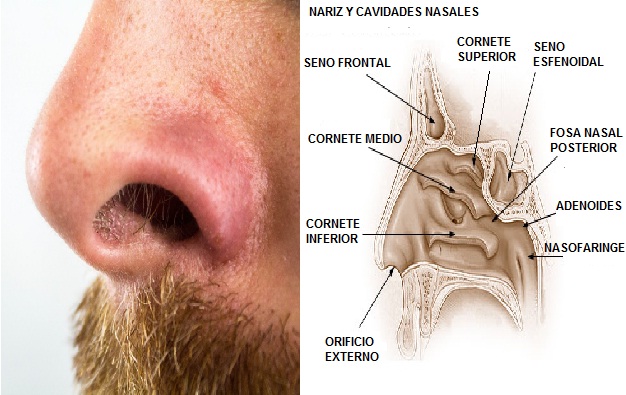
Cada día es más importante conocer los casos de portación de S. aureus en pacientes asintomáticos, tanto a nivel hospitalario como de la comunidad, ya que se han encontrado cepas multirresistentes, siendo un verdadero peligro como factor diseminador.
Por otra parte, el análisis microbiológico del exudado nasal, así como del exudado faríngeo, es un requisito exigido en algunos países para el proceso de selección del personal que va a ingresar a empresas que manipulan alimentos.
Esto es una medida preventiva, ya que el S. aureus produce una enterotoxina que causa intoxicación alimentaria. La muestra de exudado nasal es muy fácil de tomar, aunque es algo molesta para el paciente.
Índice del artículo
La toma de muestra de exudado nasal sirve para realizar dos tipos de estudios. En primer lugar se puede realizar la citología nasal con recuento de eosinófilos y en segundo lugar es útil para el análisis microbiológico.
La citología de exudado nasal es necesaria en caso de pacientes que sufren ciertos tipos de afecciones respiratorias, alergias o rinopatías, entre otros. Al alergólogo le interesa saber qué tipo de células se desprenden del epitelio nasofaríngeo, así como el recuento de eosinófilos.
El resultado del examen puede orientar sobre el origen de la rinitis, si es alérgica o infecciosa o si la rinopatía es de tipo inflamatoria o no. Así mismo, se puede diferenciar entre una bronquitis alérgica de una bronquitis infecciosa.
Sin embargo, este estudio debe ir acompañado de otros análisis para que pueda tener una verdadera utilidad, pues se deben asociar los resultados obtenidos con otros parámetros de importancia, como por ejemplo hematología completa, determinación de IgE, o seriado de heces.
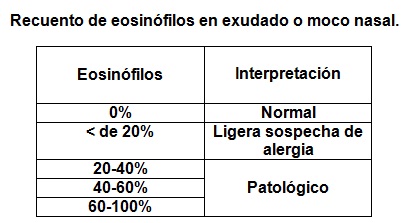
Cabe destacar que en bebés menores de 3 meses de edad puede existir eosinofilia nasal sin patología asociada. Sin embargo, después de esta edad la presencia de eosinofilia en moco nasal sin sintomatología puede ser indicativa de una futura aparición de un proceso alérgico.
El cultivo sirve para detectar a los portadores nasales de S. aureus. Aunque la ejecución de este estudio se justifica solo en casos específicos, es útil debido a que un porcentaje importante de la población porta de forma asintomática al S. aureus.
Este análisis es principalmente importante para aquellas personas que desean trabajar manipulando alimentos. En ellas hay que descartar que no sean portadoras de este microorganismo.
También es útil en personas que tienen infecciones a repetición por S. aureus, como por ejemplo impétigo, abscesos o forúnculos, entre otras afectaciones que sugieran que el paciente pueda ser un portador crónico. A veces es importante estudiar también a los familiares más cercanos.
Por otra parte, en algunas ocasiones se le puede realizar un cultivo de exudado nasal al personal de salud, especialmente cuando existan brotes significativos de esta bacteria en el recinto hospitalario y no se haya podido determinar otra fuente posible. En todos los casos mencionados es necesario realizar el cultivo.
La toma de muestra se puede realizar de dos maneras: por exfoliación espontánea o por exfoliación forzada con hisopo.
Exfoliación espontánea
Se le pide al paciente que se suene la nariz fuertemente sobre una lámina portaobjeto. Luego, con un hisopo o asa se extiende la muestra.
Exfoliación forzada con hisopo
Se introduce el hisopo hasta llegar a los cornetes inferiores. Una vez dentro se arrastra el hisopo por las paredes dando giros para arrastrar las células. Debido a que la toma de muestra es algo incómoda, el procedimiento no debe tardar más de 10 a 15 segundos. Luego, se extiende la muestra en una lámina portaobjetos y se deja secar al aire libre.
Para la toma de muestra se procede de la siguiente manera:
– Se le pide al paciente que incline la cabeza un poco hacia atrás.
– Se introduce un hisopo a una profundidad de 1 cm aproximadamente.
– El hisopo se arrastra por las paredes de la mucosa nasal dando giros hasta tocar la mayor cantidad de superficie.
– Debe tomarse muestra de ambas fosas nasales. Si se le va a practicar citología y cultivo al paciente se deben tomar dos muestras por fosa nasal. Una será para realizar el extendido en una lámina portaobjetos y la otra para el cultivo.
Para realizar el cultivo se puede usar un solo hisopo para ambas fosas nasales. Sin embargo hay laboratorios que prefieren tomarlos con hisopos diferentes y al sembrar dividen las placas de cultivo en dos mitades, rotulando de la siguiente manera: fosa nasal derecha y fosa nasal izquierda.
En el caso del estudio citológico se recomienda hacer dos frotis, uno de la fosa nasal derecha y otro de la izquierda.
Lo ideal es que una vez tomada la muestra se procese al cultivo, sin embargo esto no es posible en la mayoría de los casos.
El o los hisopos se introducen en un medio de transporte si no van a procesarse de manera inmediata. Allí pueden permanecer a temperatura ambiente. Lo ideal es que se siembre el hisopo en menos de 2 horas; sin embargo en el medio de transporte puede aguantar hasta 24 horas.
La muestra se debe sembrar en agar sangre y manitol salado. El agar sangre y el manitol salado garantizan el aislamiento de S. aureus.
Los frotis realizados se colorean con Wright o Giemsa y se observan al microscopio.
En la citología se puede observar una gran diversidad de elementos celulares, dependiendo de la condición del paciente. Cada uno de estos elementos orientará al médico hacia la posible patología. Si bien no es una prueba contundente, sí ayuda a realizar diagnósticos diferenciales.
Entre los elementos que podemos encontrar se tienen:
– Células escamosas.
– Macrófagos.
– Células cilíndricas ciliadas.
– Cristales de Charcot Leyden.
– Células caliciformes.
– Polimorfonucleares.
– Eosinófilos.
– Linfocitos.
– Células plasmáticas.
Para esta técnica se puede utilizar la coloración de Hansel, descrita a continuación.
Materiales
– Eosina.
– Azul de metileno.
– Agua destilada.
– Etanol al 95%.
Procedimiento
Una vez seco el frotis al aire libre se procede a colorear:
– Sobre el frotis se colocan unas gotas de eosina hasta cubrir toda la preparación durante 1 minuto.
– Se adiciona encima de la eosina la misma cantidad de agua destilada por 1 minuto.
– Se tira el líquido y lavar con agua destilada.
– Inclinar la lámina y dejar caer sobre la superficie unas gotas de etanol en forma de lavado.
– Adicionar unas gotas de azul de metileno hasta cubrir la totalidad del frotis durante 1 minuto.
– Adicionar la misma cantidad de agua encima del azul de metileno y dejar por 2 minutos.
– Tirar el líquido y lavar con agua destilada.
– Finalmente se adicionan unas gotas de etanol y se seca al aire libre.
En un total de 100 campos se mide el porcentaje de eosinófilos observados.
– Antes de la toma de muestra el paciente no debe haberse colocado gotas, ni lavados nasales.
– Para realizar el cultivo el paciente no debe estar recibiendo tratamiento con antibióticos.
– Para el recuento de eosinófilos el paciente no puede estar en tratamiento con antialérgicos.
– Hay que tener en cuenta que esta prueba es muy inespecífica y que puede dar falsos negativos en pacientes alérgicos tratados con esteroides.
- Protocolo, toma y transporte de muestras para microbiología. Hospital Donostia. Disponible en: osakidetza.euskadi.eus
- Fosch S, Yones C, Trossero M, Grosso O, Nepote A. Portación nasal de Staphylococcus aureus en individuos de la comunidad: factores epidemiológicos. Acta bioquím. clín. latinoam. 2012; 46 (1):59-68. Disponible en: scielo.org.
- Platzer L, Aranís C, Beltrán C, Fonseca X, García P. Colonización nasal bacteriana en población sana de la ciudad de Santiago de Chile: ¿Existe portación de Staphylococcus aureus meticilino resistente comunitario? Rev. Otorrinolaringol. Cir. Cabeza Cuello, 2010; 70 (2): 109-116. Disponible en: scielo.org.
- Díaz A, Bravo M, Ceruti E, Casar C. Valor del recuento de eosinófilos en secreción nasal en el diagnóstico diferencial de los cuadros bronquiales obstructivos del niño. Rev. Chilena Pediatría. 1973; 44 (4):341-343.
- Vallejos G, Téllez R, González A, Mena J, Reynoso V. Implicaciones de los eosinófilos en el moco nasal de pacientes con diagnóstico posible de rinitis alérgica. AN ORL MEX , 2007; 52 (2): 58-62
