Isomería: definición, tipos y ejemplos
¿Qué es la isomería?
La isomería es un fenómeno químico que se caracteriza en que moléculas con el mismo número de átomos presentan propiedades químicas o físicas diferentes. Así, se da en los isómeros, los cuales a su vez son moléculas cuyas fórmulas químicas son iguales, pero sus estructuras o disposiciones espaciales difieren sustancialmente unas de otras.
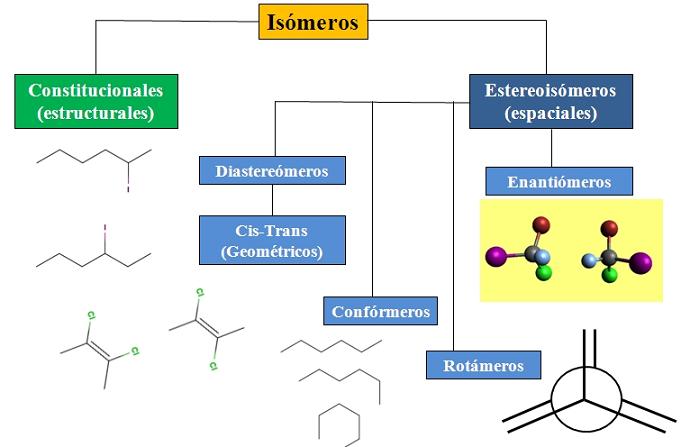
Tenemos la isomería constitucional o estructural, y la isomería espacial, la cual concentra mucha atención en la estereoquímica. El diagrama de flujo de la imagen inferior muestra que los isómeros se dividen principalmente en los dos tipos de isomería recién mencionados: constitucionales y estereoisómeros.
Todos los isómeros, para un determinado compuesto, tienen la misma fórmula química. Pero las estructuras que pueden construir dichos átomos y sus proporciones es única para cada molécula o isómero. Asimismo, aunque la estructura en sí sea la misma, los átomos o grupos pueden ocupar diferentes posiciones espaciales.
En el diagrama de flujo se muestran algunos ejemplos de isómeros que se discutirán en próximos apartados.
Tipos de isómeros
Constitucionales
Los isómeros constitucionales o estructurales son aquellos que difieren en el ordenamiento del esqueleto molecular. Es decir, que sus átomos no están enlazados del mismo modo, por lo que la estructura o los grupos funcionales en cuestión pueden llegar a ser muy diferentes.
Por ejemplo, para una misma fórmula química C7H10O puede haber múltiples moléculas que cumplan con ese número de átomos; todas tendrán un único átomo de oxígeno, pero la disposición estructural de los demás átomos será única para cada isómero.
Y por lo tanto, las propiedades químicas y físicas de todos los isómeros constitucionales para la fórmula C7H10O también diferirán enormemente entre sí.
Por otro lado, los isómeros constitucionales pueden ser muy simples, variando solamente en la posición relativa de un solo átomo o grupo. En el siguiente apartado se verá un ejemplo de esto y lo anterior dicho.
Estereoisómeros
Los estereoisómeros son aquellos que poseen el mismo ordenamiento estructural, pero difieren en las posiciones y orientaciones espaciales de sus átomos o grupos.
Para que sea posible su existencia, las moléculas deben contener centros estereogénicos, siendo los más famosos en química orgánica los átomos de carbono asimétricos o quirales; es decir, con cuatro sustituyentes distintos.
Además de los carbonos asimétricos, la molécula considerada debe carecer de elementos de simetría. De lo contrario, resulta imposible que el ordenamiento espacial devenga en estereoisomería.
Enantiómeros
Los enantiómeros son estereoisómeros que consisten en imágenes especulares no superponibles. Por ejemplo, las manos derecha e izquierda no son superponibles, al igual que los zapatos o los guantes. En el siguiente apartado se abordará el ejemplo clásico de la enantiomería: el bromocloroyodometano: CBrClI.
Diastereómeros
Los diastereómeros, por otra parte, también son estereoisómeros pero que no son imágenes especulares. Es decir, que puestos uno enfrente del otro no son el reflejo de ellos mismos. De los diastereómeros más conocidos tenemos la isomería cis-trans, llamada también isomería geométrica, especialmente cuando se aplica a los alquenos.
Confórmeros
Los confórmeros, aunque estén dentro del espectro de la estereoisomería, no son isómeros en realidad. Se tratan de configuraciones espaciales que una molécula, en determinado momento o estado energético, adquiere mediante las rotaciones de varios de sus enlaces. Se verá en el próximo apartado el ejemplo de los confórmeros del n-hexano.
Rotámeros
Finalmente tenemos los rotámeros, los cuales se parecen a los confórmeros en el sentido que dependen de la rotación de los enlaces covalentes.
Sin embargo, se toma como referencia un solo enlace entre dos átomos de carbono, y se comparan las posiciones relativas, séanse eclipsadas o alternadas, de los sustituyentes para ambos carbonos. Más adelante se verá el ejemplo de los rotámeros del propileno.
Ejemplos de isómeros
Yodo hexano
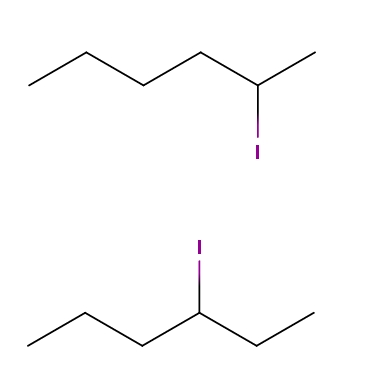
Arriba tenemos dos moléculas cuyas fórmulas químicas son C6H13I. En la primera, tenemos el 2-yodohexano, mientras que en la segunda el 3-yodohexano. Son isómeros constitucionales de tipo posicional, pues el esqueleto es el mismo, con la diferencia de que la posición del átomo de yodo varía de un carbono a otro.
C3H8O
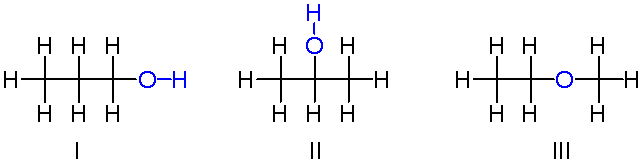
Arriba tenemos otro ejemplo de isómeros constitucionales para la fórmula química C3H8O. Las moléculas I y II son 1-propanol y 2-propanol, respectivamente. Ambos son alcoholes. En cambio, la molécula III se trata del etil-metil-éter.
Por lo tanto, hablamos de otro grupo funcional. Nótese que las tres moléculas poseen el mismo número de átomos, pero sus estructuras son diferentes.
2,3-dicloro-2-buteno
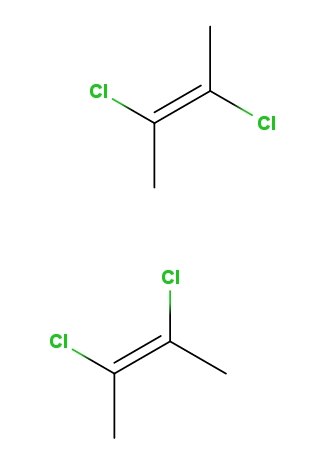
Arriba tenemos el isómero trans-2,3-dicloro-2-buteno, y abajo el isómero cis-2,3-dicloro-2-buteno. En el primero, los átomos de cloro se encuentran en posiciones contrarias respecto al doble enlace, mientras que en el segundo yacen en el mismo lado del doble enlace.
El esqueleto para ambas moléculas es el mismo, pero difieren en las posiciones espaciales de los átomos de cloro; por lo tanto, son estereoisómeros, y al no ser imágenes especulares, vienen a ser diastereómeros.
3-flúor-2-metilciclohexano
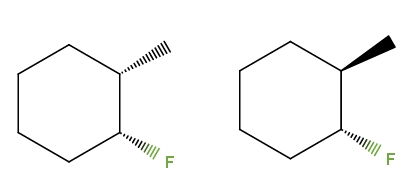
Esta vez, en lugar de un doble enlace, tenemos un anillo de ciclohexano para el compuesto 3-flúor-2-metilciclohexano. En el isómero de la izquierda, los grupos CH3 y F se sitúan por debajo del plano del anillo; mientras que en el de la derecha, el CH3 está arriba y el F abajo.
Por lo tanto, el de la izquierda correspondería al isómero cis, y el de la derecha sería el isómero trans. Son pues, diastereómeros, debido a que nuevamente no son imágenes especulares.
Confórmeros del n-hexano
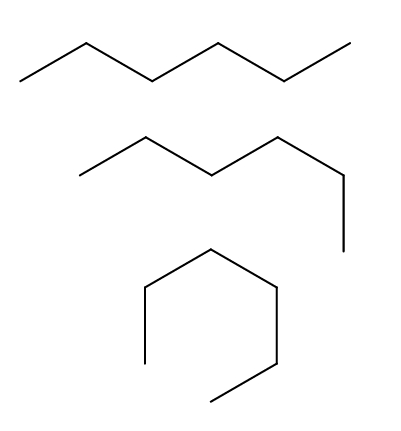
Tenemos arriba tres confórmeros del n-hexano, los cuales resultan de las rotaciones y “dobleces” de la cadena carbonada en distintas orientaciones. Todos corresponden a la misma molécula de n-hexano con diferentes niveles de plegamiento, que dependerá del entorno y de la energía interna de cada molécula.
3-bromo-2-pentanol
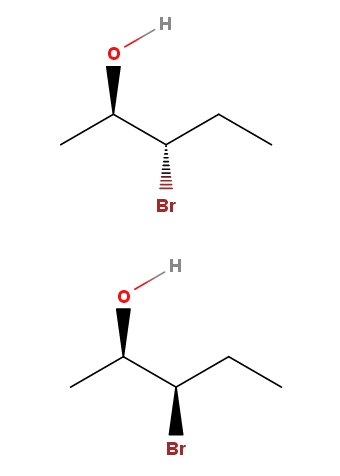
En el 3-bromo-2-pentanol tenemos otro ejemplo de un par de diastereómeros. Nótese que una vez más, en el isómero de arriba tenemos el OH y el Br apuntando hacia direcciones contraria del plano del esqueleto; mientras que en el isómero de abajo, ambos grupos apuntan hacia la dirección del lector.
1-bromo-3-cloro-5-etilciclohexano
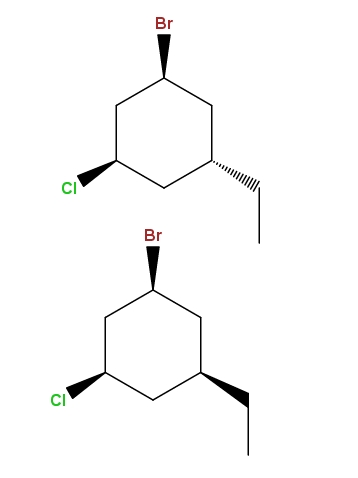
Y una vez más, tenemos otro par de diastereómeros, con la diferencia de que ahora la diferencia radica en la posición espacial de un solo grupo: el etilo, -CH2CH3.
Este tipo de isómeros tiene un nombre muy específico: epímeros, que son diastereómeros cuya variación se observa únicamente en la configuración espacial de un solo carbono asimétrico; en este caso, el que está enlazado al -CH2CH3.
Bromocloroyodometano
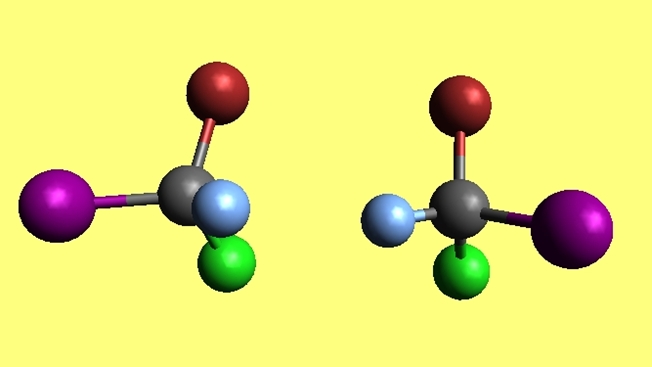
Nótese que las dos moléculas de bromocloroyodometano, CBrClI, son enantiómeros porque una es el reflejo no superponible de la otra. Por mucho que se intente, jamás coincidirán sus cuatro átomos. Se dice que poseen configuraciones espaciales opuestas.
2-bromo-4-etilciclohexano
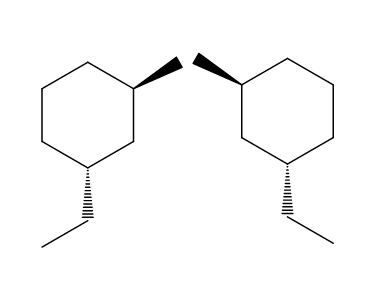
En el ejemplo del par de moléculas de 2-bromo-4-etilciclohexano es todavía más evidente la enantiomería. Si intentamos voltear la molécula de la derecha, veremos que el grupo -CH2CH3 no se ubicará por debajo del anillo sino por arriba.
De igual modo, el CH3 no apuntará hacia arriba del anillo sino por debajo. Las configuraciones espaciales se invierten, son opuestas. Esta es otra de las características más importantes de la enatiomería.
Rotámeros del propileno
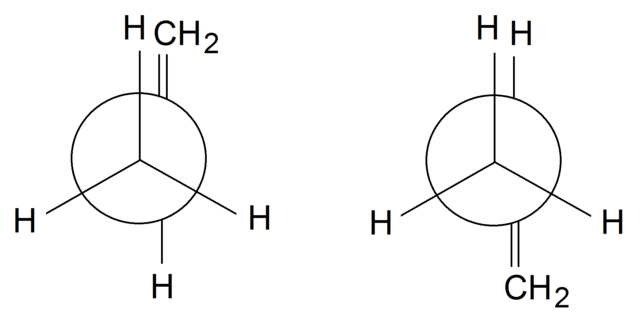
En los rotámeros del propileno, para finalizar, rotamos el enlace simple entre el C1 y C2: H3C-CH=CH2. El grupo =CH2 está en posición eclipsada con uno de los H del grupo CH3 frontal en el rotámero de la izquierda. Mientras, el =CH2 y el H están en posiciones alternadas en el rotámero de la derecha.
Dependiendo del eclipsamiento o no de los grupos, tendremos impedimento estérico, lo cual desestabilizará el rotámero. Por lo tanto, el rotámero de la derecha es más estable que el de la izquierda.
Referencias
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Dr. S. Gevorg. (2020). Enantiomers, Diastereomers, Identical or Constitutional Isomers. Chemistry Steps. Recuperado de: chemistrysteps.com
- Wikipedia. (2020). Isomer. Recuperado de: en.wikipedia.org
- Allison Soult. (13 de agosto de 2020). Isomers. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- James Ashenhurst. (2020). Stereochemistry and Chirality. Recuperado de: masterorganicchemistry.com
