Ley de Henry: explicación, fórmula, ejemplos, excepciones

¿Qué es la Ley de Henry?
La Ley de Henry es la relación que describe el efecto de la presión sobre la solubilidad de los gases. Esta ley establece que la solubilidad de un gas en contacto con la superficie de un líquido a una temperatura determinada es directamente proporcional a la presión parcial de dicho gas sobre el líquido.
Esto quiere decir que, mientras mayor sea la presión del gas sobre un líquido, mayor será la cantidad total del gas que se podrá disolver en el mismo, obteniéndose así una mayor concentración (es decir, mayor será la solubilidad).
La Ley de Henry la vemos en acción cada vez que destapamos una bebida gaseosa. Al estar cerrada, la alta presión dentro de la botella mantiene al gas carbónico disuelto. Pero al destaparla, la presión del gas disminuye, lo que reduce su solubilidad y se escapa formando burbujas y efervescencia.
La fórmula de la Ley de Henry
En forma matemática, la Ley de Henry se expresa como una ley de proporcionalidad:

Esta ley de proporcionalidad se transforma en:

Donde C se refiere a la concentración máxima del gas en el líquido, es decir, su solubilidad; Pgas es la presión parcial del gas en contacto con el líquido y kH es una constante de proporcionalidad denominada constante de la Ley de Henry.
La concentración del gas se puede expresar en distintas unidades tales como molaridad, molalidad o fracción molar. Sin embargo, en la mayoría de los casos, los químicos utilizan la concentración en unidades de molaridad (en mol/L), mientras que la presión la expresan en atmósferas.
La constante de la Ley de Henry (kH)
La constante kHdescribe las interacciones entre un gas y un solvente. Mientras más fuertes sean estas interacciones, mayor será la constante y, por ende, mayor será la solubilidad del gas en el solvente a una determinada temperatura y presión.
Numéricamente, el valor de kHrepresenta la solubilidad del gas a la temperatura dada, cuando la presión parcial del mismo es de 1 atm.
Dependiendo de las unidades de la concentración y la presión utilizadas en la ecuación, esta constante puede tener unidades de mol/L.atm, mol/kg.atm, etc.
En la siguiente tabla se presentan los valores de la constante de la Ley de Henry para algunos gases comunes en agua a 25°C:

Estos valores disminuyen con la temperatura, ya que la solubilidad de los gases en general disminuye a mayor temperatura.
Explicación de la Ley de Henry
La Ley de Henry es muy fácil de entender desde el punto de vista microscópico. Podemos imaginar a un gas como un conjunto de partículas muy pequeñas rebotando en todas las superficies que tocan. Cuando chocan con la superficie de un líquido, algunas partículas rebotarán, mientras que otras atravesarán la superficie quedando atrapadas (es decir, se disolverán).
Lo mismo sucede con las partículas del gas que están disueltas. Ellas rebotan con las paredes del recipiente y también pueden llegar a la superficie del líquido, donde algunas rebotarán mientras que otras atravesarán la superficie y se escaparán a la fase gaseosa.
Al alcanzarse el equilibrio, las velocidades con la que el gas se disuelve en el solvente y con la que se escapa del mismo son iguales, por lo que la concentración permanece constante.

Cuando aumentamos la presión del gas, lo que estamos haciendo es aumentar la frecuencia con la que las partículas del gas chocan con la superficie del líquido. Esto hace que la velocidad con la que el gas se disuelve aumente. Al alcanzarse un nuevo equilibrio, la nueva concentración del gas será mayor.
Excepciones a la Ley de Henry
Es importante resaltar que la Ley de Henry es una ley ideal, que solo describe el comportamiento de las soluciones de gases reales bajo ciertas condiciones. Así, solo se puede aplicar la Ley de Henry cuando:
- La temperatura permanece constante.
- El gas se encuentra en equilibrio con la solución.
- La presión del gas es relativamente baja.
- El gas no reacciona con el solvente.
A pesar de esto, incluso en algunos casos en los que el gas sí reacciona con el solvente, esta ley se puede aplicar de manera aproximada.
Ejemplos de aplicación de la Ley de Henry
Ejemplo 1: Determinación de la constante de la Ley de Henry
Se determinó experimentalmente que la concentración de una solución acuosa en equilibrio con neón a una presión de 3,00 atm y 25°C es de 0,00135 mol/L. Determine la constante de la Ley de Henry para el neón en agua a 25°C.
Solución:
Según la Ley de Henry:


Por lo tanto, la constante de la Ley de Henry para el neón en agua a 25°C es de 4,50×10-4 mol/L.atm.
Ejemplo 2: Determinación de la solubilidad de un gas
Utilizando la constante de la Ley de Henry proporcionada en la tabla anterior, determine la solubilidad del dióxido de carbono del aire en agua a nivel del mar, sabiendo que la fracción molar de dicho gas en el aire es de 3,14×10-4.
Solución:
A nivel del mar, la presión del aire es de 1 atm, y la presión parcial del CO2 viene dada por:

Sustituyendo esta expresión en la Ley de Henry:



Ejemplo 3: Los gases de buceo
Cuando un buzo nada a profundidades mayores que 30 metros, debe respirar una mezcla de aire con otros gases inertes como helio o argón, ya que el aumento de la concentración de nitrógeno en la sangre predicho por la Ley de Henry tiene efectos narcóticos que causan desorientación, confusión y problemas de visión.
Este efecto se comienza a observar al respirar aire (XN2=0,78) a una presión de 4,00 atm. Si un buzo planea descender hasta los 100 metros de profundidad, donde la presión es de alrededor de 11,0 atm, ¿cuál es la fracción máxima de nitrógeno que puede respirar antes de sufrir de narcosis?
Solución:
En base al enunciado, podemos deducir que la concentración máxima de nitrógeno es la que se da cuando la presión del aire es de 4,00 atm. Según la Ley de Henry y utilizando la relación entre presión total y presión parcial del ejemplo anterior:

Esta debe ser la misma concentración máxima a cualquier presión total. Así que, a 100 metros:
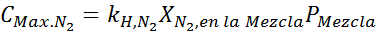
Igualando ambas ecuaciones, podemos hallar la fracción molar máxima del nitrógeno en la mezcla:



Esto quiere decir que el buzo no debe utilizar una mezcla que contenga más del 28,4% de nitrógeno si planea sumergirse hasta 100 metros de profundidad.
