Ácido mangánico o permangánico: qué es, características, usos
¿Qué es el ácido mangánico o permangánico?
El ácido mangánicoo permangánico es un ácido dibásico de fórmula H2MnO4. Es un oxoácido de manganeso. Se encuentra solo en solución y en sales de manganato.
- Nombre sistemático: Dihidrógeno (tetraóxidomanganato).
- Tipo de compuesto: Oxoácidos (combinaciones ternarias formadas por hidrógeno, un elemento no metal y el oxígeno).
- Fórmula molecular: H2MnO4
- Masa molecular: 120.9515
Ejemplos de reacciones
MnO3+ H₂O = H2MnO4
KMnO4+ H2O2= KO2+ H2MnO4
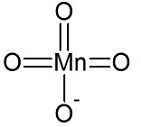
Características del ácido permangánico
– Las soluciones de ácido permangánico (hasta un 20%) son líquidos púrpuras, con un olor a ozono. El hidrato de cristal (HMnO4· 2H2O) es un sólido cristalino púrpura que se descompone por encima de 20° C.
– Es un oxidante muy fuerte, aunque más suave que su anhídrido. Se descompone espontáneamente, envolviendo el oxígeno y precipitando el dióxido de manganeso, que cataliza la descomposición adicional del ácido.
– Enfriando la solución concentrada inestable del ácido cerca del punto de congelación, se puede preparar el hidrato de cristal. Las fuentes varían en función de la naturaleza de este compuesto: según algunas fuentes, es una sal de hidronio de ácido permangánico, según otros, es un complejo ácido polimangánico.
– Las soluciones excesivamente concentradas de este ácido pueden descomponerse espontáneamente con la evolución del ozono. Esto permite preparar el ozono químicamente haciendo reaccionar el permanganato de potasio con ácido sulfúrico de concentración media (50-80%).
– Esta reacción produce una solución excesivamente concentrada de ácido permangánico, que se descompone rápidamente, liberando el ozono.
– No se debe utilizar ácido sulfúrico con una concentración por encima del 80% para esta reacción, ya que puede conducir a la formación del anhídrido (epóxido de manganeso), el cual es extremadamente peligroso.
Preparación
El ácido permangánico puede prepararse disolviendo epóxido de manganeso en agua, o haciendo reaccionar el permanganato de bario con ácido sulfúrico. También se puede preparar una solución impura disolviendo el permanganato de potasio en ácido sulfúrico de concentración media (50-80%).
Manejo
No se sabe mucho sobre los peligros del ácido permangánico, pero debe ser tratado con precaución porque es un ácido fuerte y un oxidante también muy fuerte. Además, puede liberar ozono, que es tóxico.
Almacenamiento
No es práctico almacenar este ácido debido a su inestabilidad. Debe ser utilizado tan pronto como se prepara. El hidrato se puede almacenar siempre y cuando esté congelado (por debajo del punto de congelación del agua).
Disposición
El ácido permangánico puede ser descargado en el suelo, ya que ocasiona que el compuesto se descomponga, oxidando el suelo y convirtiéndose en el dióxido de manganeso, que es seguro e insoluble.
Los permanganatos
El grupo aniónico univalente MnO4 es derivado del ácido permangánico, siendo todos agentes oxidantes fuertes. Son sales que contienen el anión MnO4-, normalmente de color rojo violáceo profundo y con fuertes propiedades oxidantes.
1. Permanganato de potasio
Fórmula molecular: KMnO4
Peso molecular: 158.032 g/mol
Es el más conocido de todos los permanganatos. También conocido como cristales de Condy, es un compuesto altamente oxidante, inodoro, soluble en agua y en muchos solventes orgánicos, posee cristales de color púrpura, y un sabor dulce.
El permanganato de potasio no es combustible, pero acelera la ignición del material combustible. Si el material combustible está finamente dividido, la mezcla puede ser explosiva.
Cuando entra en contacto con materiales combustibles líquidos puede provocar una ignición espontánea. En contacto con ácido sulfúrico, puede causar incendio o explosión. Se utiliza para fabricar otros productos químicos y como desinfectante.
Farmacología y bioquímica
Clasificación farmacológica: MeSH
Indicadores y reactivos
Son sustancias utilizadas para la detección, identificación y análisis de procesos o condiciones químicas, biológicas o patológicas.
Los indicadores son sustancias que cambian en aspecto físico, por ejemplo de color, cuando se aproxima al punto en que pasa entre la acidez y la alcalinidad.
Los reactivos son sustancias utilizadas para la detección o determinación de otra sustancia por medios químicos o microscópicos, en particular el análisis.
Los tipos de reactivos son precipitantes, disolventes, oxidantes, reductores, flujos y reactivos colorimétricos.
Uso industrial
Como agentes blanqueadores, agentes de olor y agentes oxidantes / reductores.
Métodos de fabricación
Pueden prepararse oxidando dióxido de manganeso con clorato de potasio en solución de hidróxido de potasio, luego completando la oxidación con cloro o aire y dióxido de carbono.
Seguridad y peligros
– Puede intensificar el fuego.
– Es nocivo por ingestión.
– Provoca quemaduras graves en la piel.
– Puede causar lesiones oculares.
– Puede provocar irritación de las vías respiratorias.
– Se sospecha que causa defectos genéticos.
– Se tiene la sospecha de que puede dañar la fertilidad y el feto.
– Provoca daños a los órganos tras exposiciones prolongadas o repetidas.
– Es muy tóxico para los organismos acuáticos, con efectos nocivos duraderos.
Peligro para la salud
Puede ocasionar quemaduras y manchas en la piel de color marrón oscura. Si se ingiere produce severa afectación del sistema gastrointestinal. Puede ser fatal si se consumen sobre 4 onzas.
Peligro de incendio
No es combustible, pero aumenta la combustión de otras sustancias. Provoca gases o vapores irritantes o tóxicos en el fuego.
Comportamiento en fuego: puede causar fuego en contacto con combustibles causando que contenedores puedan explotar. Puede ocasionar un gran riesgo de incendio y explosión en contacto con sustancias combustibles o agentes reductores.
Peligros químicos
Se descompone al calentarse y esto produce gases tóxicos y humos irritantes. La sustancia es un oxidante fuerte. Reacciona con materiales combustibles y reductores, lo que genera peligro de incendio y explosión. Reacciona violentamente con metales en polvo, lo que genera peligro de incendio.
Primeros auxilios si se entra en contacto con el permanganato de potasio
Si se ingiere, hay que inducir el vómito y seguir con un lavado gástrico completo.
Si se inhala se requiere aire fresco y descanso. La respiración artificial puede ser necesaria. Es indispensable consultar a un médico.
Si entra en contacto con la piel, enjuagar con abundante agua durante 15 minutos al menos y luego retirar la ropa contaminada y enjuagar de nuevo. Es importante también consultar a un médico.
Si entra en contacto con los ojos, enjuagar con abundante agua por varios minutos. Solicite atención médica.
2. Permanganato de sodio
Fórmula molecular: MnNaO4
Peso molecular: 141.924 g/mol
El permanganato sódico es un sólido cristalino de color purpúreo. No combustible, pero acelera la quema de material combustible. Puede encenderse espontáneamente en contacto con materiales combustibles líquidos.
El contacto con ácido sulfúrico puede causar incendios o explosiones. Usado en medicina, como desinfectante, y para muchos otros usos.
Uso y fabricación
Se emplea en la industria como agente oxidante y reductor. También se usa para el tratamiento de aguas, y para blanquear textiles.
Métodos de fabricación
El manganato sódico se disuelve en agua y se introduce cloro u ozono. La solución se concentra y cristaliza.
3. Permanganato de calcio
Fórmula molecular: CaMn2O8
Peso molecular: 277.946 g/mol
Características
El permanganato de calcio es un sólido cristalino púrpura. Se utiliza como desinfectante y desodorante, en la purificación del agua, y para muchos otros usos.
Uso médico
El ion mangánico resultante de este permanganato es astringente, lo que ayuda a suprimir la inflamación.
