Soluciones amortiguadoras: concepto, propiedades, tipos, ejemplos

¿Qué son las soluciones amortiguadoras?
Las soluciones amortiguadoras, también llamadas soluciones tampón, reguladoras de pH o buffers, son soluciones acuosas formadas por un ácido débil y su base conjugada o por una base débil y su ácido conjugado.
Se llaman soluciones amortiguadoras, ya que tienen la capacidad de amortiguar el cambio de pH luego de la adición de ácidos o bases en pequeñas cantidades, incluso si se trata de ácidos o bases fuertes.
Las soluciones amortiguadoras son de gran utilidad, ya que permiten mantener constante el pH. Existen muchas reacciones químicas que necesitan un pH determinado y constante para funcionar bien.
Propiedades de las soluciones amortiguadoras
Son soluciones acuosas
Tanto el concepto de pH como la escala de pH solo tienen sentido en soluciones acuosas, así que todos los buffers o soluciones amortiguadoras son preparadas en agua.
Su funcionamiento se basa en el equilibrio ácido-base y en los principios de Le Chatelier
Los buffers se basan en reacciones de disociación ácido/base reversibles que se encuentran en equilibrio. Al agregar ácidos o bases fuertes al medio, se perturba este equilibrio, por lo que el sistema reacciona para contrarrestar la perturbación, siguiendo los principios de Le Chatelier. Así es como los buffers logran amortiguar los grandes cambios en el pH.
Su pH se calcula fácilmente con la ecuación de Henderson-Hasselbalch
Sin importar de qué tipo de solución amortiguadora se trate, su pH tanto antes como después de añadir pequeñas cantidades de ácidos o bases fuertes, se puede calcular por medio de la ecuación de Henderson-Hasselbalch:
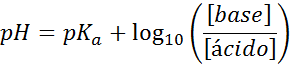
Donde [base] se refiere a la concentración molar de la base (o la sal de la base conjugada) y [ácido] se refiere a la concentración molar del ácido (o de la sal del ácido conjugado).
Son capaces de neutralizar parcialmente tanto a ácidos como a bases
Las soluciones amortiguadoras están conformadas por una sustancia básica y una sustancia ácida, las cuales pueden neutralizar bases y ácidos, respectivamente. Por esta razón, pueden amortiguar el pH tras la adición tanto de ácidos fuertes como de bases fuertes.
Su funcionamiento depende de la temperatura
El pH de una solución amortiguadora depende de la constante de acidez o basicidad del ácido o base débil que contiene. Esta constante depende de la temperatura, por lo que el funcionamiento de estas soluciones también depende de la temperatura.
Mientras más concentradas, mayor es su capacidad de amortiguar o regular el pH
La capacidad amortiguadora depende de que la concentración total de la solución sea mayor que la concentración final del ácido o base fuerte que se agregue. Por esta razón, mientras mayor sea la concentración total de la solución amortiguadora, mayor será su capacidad de amortiguar ácidos o bases fuertes.
Componentes de una solución amortiguadora o buffer
Químicamente, las soluciones amortiguadoras están formadas por solo dos componentes. Estos componentes pueden ser un ácido débil mezclado con una sal de su base conjugada o una base débil mezclada con una sal de su ácido conjugado.
Existen dos formas diferentes de obtener estos componentes en una misma solución, como veremos a continuación:
1. Preparación de buffers mezclando soluciones de sus componentes
Esta es la forma más directa de preparar una solución amortiguadora. Para ello, se preparan soluciones separadas del ácido débil (por ejemplo, ácido acético) y de una sal de la base conjugada (por ejemplo, acetato de sodio). Luego se van mezclando poco a poco ambas soluciones hasta obtener el pH deseado.

- Se mezclan las soluciones poco a poco hasta obtener el pH deseado
2. Preparación de buffers por neutralización parcial de una solución de un ácido débil
En este caso, se prepara una solución del ácido débil con la concentración total deseada, y luego se va agregando hidróxido de sodio o de potasio poco a poco hasta alcanzar el pH deseado.
Tipos de soluciones buffer
Las soluciones amortiguadoras se pueden clasificar según los tipos de componentes que posean o según su pH final.
Según los tipos de componentes:
- Buffer de ácido débil y base conjugada: En estos casos el pH depende del pKa del ácido débil.
- Buffer de base débil y ácido conjugado: En estos casos, el pH depende del pKb de la base débil.
- Buffer de sales de ácidos polipróticos: En algunos casos tanto el que hace el papel del ácido débil como su base conjugada son ambas sales provenientes de la neutralización parcial de un ácido que tenga varios protones tales como el ácido sulfúrico o el fosfórico.
Según su pH final:
Dependiendo de la constante de acidez o basicidad, una solución amortiguadora puede regular el pH alrededor de distintos rangos de pH, dando origen a tres tipos de buffers:
- Buffers ácidos: Son aquellos que regulan el pH alrededor de valores menores que 7. Se preparan con ácidos débiles cuyo pKa sea menor que 7 o con bases débiles cuyo pKb sea mayor que 7.
- Buffers neutros: Son aquellos que regulan el pH alrededor de 7. Usualmente están conformados por ácidos o bases débiles que tienen un pKa o un pKb cercano a 7.
- Buffers alcalinos: Son aquellos que regulan el pH alrededor de valores mayores que 7. Se preparan con ácidos débiles cuyo pKa sea mayor que 7 o con bases débiles cuyo pKb sea menor que 7.
Ejemplos de buffers o soluciones amortiguadoras
Buffer ácido acético/acetato de sodio
Este es un buffer de un ácido débil (ácido acético) y una sal de su base conjugada (acetato de sodio). El equilibrio involucrado y su constante de equilibrio son:
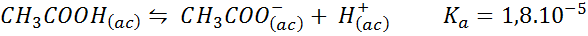
Este buffer regula el pH alrededor de 4,74.
Buffer de amoníaco/cloruro de amonio
Este es un buffer de una base débil (amoníaco o hidróxido de amonio) y una sal de su ácido conjugado (cloruro de amonio). El equilibrio involucrado y su constante de equilibrio son:
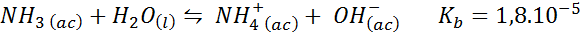
Este es un buffer alcalino que regula el pH alrededor de 9,26.
Buffer bisulfato/sulfato
En este caso, el ion bisulfato hace el papel de ácido débil cuya base conjugada es el ion sulfato. El equilibrio involucrado es:
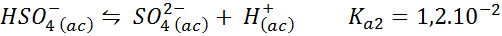
Este es una solución amortiguadora ácida que regula el pH alrededor de 3,05.
Buffer ácido carbónico/bicarbonato
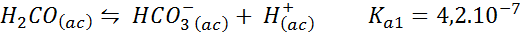
Este buffer regula el pH alrededor de 6,38.
Buffer dihidrógeno fosfato/hidrógeno fosfato
Este es uno de los sistemas de regulación de pH más utilizados en biología y bioquímica, ya que permite regular el pH muy cerca del pH fisiológico al que ocurren la mayoría de las reacciones químicas dentro de las células. La reacción es:
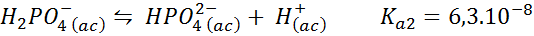
Este buffer regula el pH alrededor de 7,20.
