Método de balanceo por redox: pasos, ejemplos, ejercicios
El método de balanceo por redox es aquel que permite balancear las ecuaciones químicas de las reacciones redox, que de otra manera resultarían un dolor de cabeza. Aquí una o más especies intercambian electrones; la que los dona o pierde, se llama especie oxidante, mientras que la que los acepta o gana, especie reductora.
En este método es primordial conocer los números de oxidación de estas especies, ya que revelan cuántos electrones han ganado o perdido por mol. Gracias a esto, es posible balancear las cargas eléctricas escribiendo en las ecuaciones los electrones como si fueran reactantes o productos.
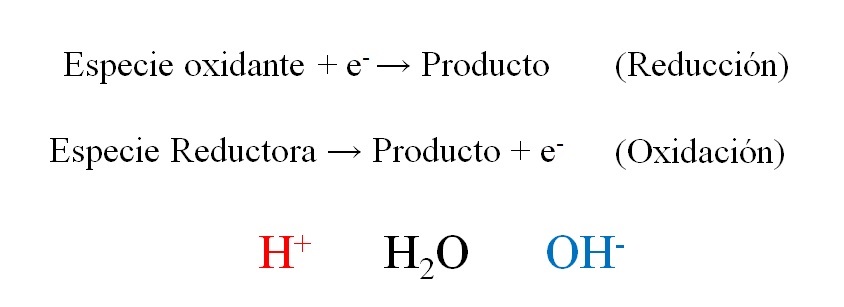
La imagen superior muestra como efectivamente los electrones, e– se colocan como reactivos cuando la especie oxidante los gana; y como productos cuando la especie reductora los pierde. Nótese que para balancear este tipo de ecuaciones es necesario dominar los conceptos de números de oxidación y oxidación-reducción.
Las especies H+, H2O y OH–, dependiendo del pH del medio de reacción, permite el balanceo redox, por lo que es muy común encontrarlas en los ejercicios. Si el medio es ácido, recurrimos a los H+; pero si por el contrario el medio es básico, entonces usamos los OH– para el balanceo.
La naturaleza de la reacción por sí misma dictamina cuál debe ser el pH del medio. Es por eso que si bien puede procederse a balancear asumiendo un medio ácido o básico, la ecuación final balanceada indicará si son prescindibles o no realmente los iones H+ y OH–.
Índice del artículo
Chequear los números de oxidación de los reactivos y productos
Supóngase la siguiente ecuación química:
Cu(s) + AgNO3(ac) → Cu(NO3)2 + Ag(s)
Esta corresponde a una reacción redox, en la que ocurre un cambio en los números de oxidación de los reactivos:
Cu0(s) + Ag+NO3(ac) → Cu2+(NO3)2 + Ag(s)0
Identificar las especies oxidante y reductora
La especie oxidante gana electrones oxidando a la especie reductora. Por lo tanto, su número de oxidación disminuye: se torna menos positivo. Mientras, el número de oxidación de la especie reductora aumenta, ya que pierde electrones: se torna más positivo.
Así, en la reacción anterior el cobre se oxida, ya que pasa de Cu0 a Cu2+; y la plata se reduce, pues pasa de Ag+ a Ag0. El cobre es la especie reductora, y la plata la especie oxidante.
Escribir las semirreacciones y balancear átomos y cargas
Identificando qué especies ganan o pierden electrones, se escriben las semirreacciones redox tanto para la reacción de reducción como para la de oxidación:
Cu0 → Cu2+
Ag+ → Ag0
El cobre pierde dos electrones, mientras que la plata gana uno. Colocamos los electrones en ambas semirreacciones:
Cu0 → Cu2+ + 2e–
Ag+ + e– → Ag0
Nótese que las cargas permanecen balanceadas en ambas semirreacciones; pero si se sumaran, se violaría la ley de la conservación de la materia: el número de electrones debe ser igual en las dos semirreacciones. Por lo tanto, la segunda ecuación se multiplica por 2 y se procede a sumar las dos ecuaciones:
(Cu0 → Cu2+ + 2e–) x 1
(Ag+ + e– → Ag0) x 2
Cu0 + 2Ag+ + 2e– → Cu2+ + 2Ag0 + 2e–
Los electrones se cancelan por estar en los lados de los reactivos y productos:
Cu0 + 2Ag+ → Cu2+ + 2Ag0
Esta es la ecuación iónica global.
Sustituir coeficientes de la ecuación iónica en la ecuación general
Por último, los coeficientes estequiométricos de la ecuación anterior se trasladan a la primera ecuación:
Cu(s) + 2AgNO3(ac) → Cu(NO3)2 + 2Ag(s)
Nótese que el 2 se posicionó con el AgNO3 porque en esta sal la plata está como Ag+, y lo mismo sucede con el Cu(NO3)2. Si esta ecuación no está balanceada al final, se procede a realizar el tanteo.
La ecuación propuesta en los pasos anteriores pudo haberse balanceado directamente por tanteo. Sin embargo, hay reacciones redox que necesitan de un medio ácido (H+) o básico (OH–) para tener lugar. Cuando esto sucede, no se puede balancear asumiendo que el medio es neutro; tal como acaba de mostrarse (no se adicionó ni H+ y tampoco OH–).
Por otro lado, conviene saber que en las semirreacciones se escriben los átomos, iones o compuestos (óxidos en su mayoría) en los que ocurren los cambios en los números de oxidación. Esto se resaltará en el apartado de los ejercicios.
Cuando el medio es ácido hay que detenerse en las dos semirreacciones. Esta vez al momento de balancear ignoramos los átomos de oxígeno y de hidrógeno, y también los electrones. Los electrones se balancearán al final.
Luego, en el lado de la reacción con menos átomos de oxígeno, añadimos moléculas de agua para compensarlo. Del otro lado, balanceamos los hidrógenos con iones H+. Y finalmente, añadimos los electrones y se procede siguiendo los pasos generales ya expuestos.
Cuando el medio es básico, se procede del mismo modo que en el medio ácido con una pequeña diferencia: esta vez del lado donde haya más oxígenos, se situarán un número moléculas de agua igual a este exceso de oxígeno; y del otro lado, iones OH– para compensar los hidrógenos.
Finalmente, se balancean los electrones, se suman las dos semirreacciones, y se sustituyen los coeficientes de la ecuación iónica global en la ecuación general.
Las siguientes ecuaciones redox sin balancear y balanceadas sirven de ejemplos para observar qué tanto cambian después de aplicar este método de balanceo:
P4 + ClO– → PO43- + Cl– (sin balancear)
P4 + 10 ClO– + 6 H2O → 4 PO43- + 10 Cl– + 12 H+ (balanceada medio ácido)
P4 + 10 ClO– + 12 OH– → 4 PO43- + 10 Cl– + 6 H2O (balanceada medio básico)
I2 + KNO3 → I– + KIO3 + NO3– (sin balancear)
3I2 + KNO3 + 3H2O → 5I– + KIO3 + NO3– + 6H+ (balanceada medio ácido)
Cr2O27- + HNO2 →Cr3+ + NO3− (sin balancear)
3HNO2 + 5H+ + Cr2O27- →3NO3– +2Cr3+ + 4H2O (balanceada medio ácido)
Balancear la siguiente ecuación en medio básico:
I2 + KNO3 → I– + KIO3 + NO3–
Pasos generales
Empezamos por escribir los números de oxidación de las especies que sospechamos se han oxidado o reducido; en este caso, los átomos de yodo:
I20 + KNO3 → I– + KI5+O3 + NO3–
Nótese que el yodo se oxida y al mismo tiempo se reduce, por lo que procedemos a escribir sus dos semirreacciones respectivas:
I2 → I– (reducción, por cada I– se consume 1 electrón)
I2 → IO3– (oxidación, por cada IO3– se liberan 5 electrones)
En la semirreacción de oxidación colocamos el anión IO3–, y no al átomo de yodo como I5+. Balanceamos los átomos de yodo:
I2 → 2I–
I2 → 2IO3–
Balanceo en medio básico
Ahora nos centramos en balancear en medio básico la semirreación de oxidación, ya que esta posee una especie oxigenada. Agregamos en el lado de los productos el mismo número de moléculas de agua como átomos de oxígeno haya:
I2 → 2IO3– + 6H2O
Y del lado izquierdo balanceamos los hidrógenos con OH–:
I2 + 12OH– → 2IO3– + 6H2O
Escribimos las dos semirreacciones y añadimos los electrones faltantes para balancear las cargas negativas:
I2 + 2e– → 2I–
I2 + 12OH– → 2IO3– + 6H2O + 10e–
Igualamos en ambas semirreacciones los números de los electrones y las sumamos:
(I2 + 2e– → 2I–) x 10
(I2 + 12OH– → 2IO3– + 6H2O + 10e–) x 2
12I2 + 24 OH– + 20e– → 20I– + 4IO3– + 12H2O + 20e–
Los electrones se cancelan y dividimos todos los coeficientes entre cuatro para simplificar la ecuación iónica global:
(12I2 + 24 OH– → 20I– + 4IO3– + 12H2O) x ¼
3I2 + 6OH– → 5I– + IO3– + 3H2O
Y finalmente, sustituimos los coeficientes de la ecuación iónica en la primera ecuación:
3I2 + 6OH– + KNO3 → 5I– + KIO3 + NO3– + 3H2O
La ecuación ya está balanceada. Compare este resultado con el balanceo en medio ácido del ejemplo 2.
Balancee la siguiente ecuación en medio ácido:
Fe2O3 + CO → Fe + CO2
Pasos generales
Observamos los números de oxidación del hierro y del carbono para saber cuál de los dos se ha oxidado o reducido:
Fe23+O3 + C2+O → Fe0 + C4+O2
El hierro se ha reducido, por lo que es la especie oxidante. Mientras, el carbono se ha oxidado, comportándose como la especie reductora. Las semirreacciones para la oxidación y redución concernientes vienen a ser:
Fe23+O3 → Fe0 (reducción, por cada Fe se consumen 3 electrones)
CO → CO2 (oxidación, por cada CO2 se liberan 2 electrones)
Nótese que escribimos el óxido, Fe2O3, porque contiene al Fe3+, en lugar de solo colocar el Fe3+. Balanceamos los átomos que hagan falta excepto los de oxígeno:
Fe2O3 → 2Fe
CO → CO2
Y se procede a realizar el balanceo en medio ácido en ambas semirreacciones, ya que hay especies oxigenadas de por medio.
Balanceo en medio ácido
Añadimos agua para balancear los oxígenos, y luego H+ para balancear los hidrógenos:
Fe2O3 → 2Fe + 3H2O
6H+ + Fe2O3 → 2Fe + 3H2O
CO + H2O → CO2
CO + H2O → CO2 + 2H+
Ahora balanceamos las cargas colocando los electrones involucrados en las semirreacciones:
6H+ + 6e– + Fe2O3 → 2Fe + 3H2O
CO + H2O → CO2 + 2H+ + 2e–
Igualamos el número de electrones en ambas semirreacciones y las sumamos:
(6H+ + 6e– + Fe2O3 → 2Fe + 3H2O) x 2
(CO + H2O → CO2 + 2H+ + 2e–) x 6
12 H+ + 12e– + 2Fe2O3 + 6CO + 6H2O → 4Fe + 6H2O + 6CO2 + 12H+ + 12e–
Cancelamos los electrones, los iones H+ y las moléculas de agua:
2Fe2O3 + 6CO → 4Fe + 6CO2
Pero estos coeficientes pueden dividirse entre dos para simplificar la ecuación todavía más, teniendo:
Fe2O3 + 3CO → 2Fe + 3CO2
Surge esta pregunta: ¿era necesario el balanceo redox para esta ecuación? Por tanteo hubiera sido mucho más rápido. Esto demuestra que esta reacción procede indistintamente de cuál sea el pH del medio.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Helmenstine, Anne Marie, Ph.D. (22 de septiembre de 2019). How to Balance Redox Reactions. Recuperado de: thoughtco.com
- Ann Nguyen & Luvleen Brar. (05 de junio de 2019). Balancing Redox Reactions. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Quimitube. (2012). Ejercicio 19: Ajuste de una reacción redox en medio básico con dos semirreacciones de oxidación. Recuperado de: quimitube.com
- Washington University in St. Louis. (s.f.). Practice Problems: Redox Reactions. Recuperado de: chemistry.wustl.edu
- John Wiley & Sons. (2020). How to Balance Redox Equations. Recuperado de: dummies.com
- Rubén Darío O. G. (2015). Balanceo de ecuaciones químicas. Recuperado de: aprendeenlinea.udea.edu.co
