Citrato de sodio (C6H5O7Na3): estructura, usos, propiedades
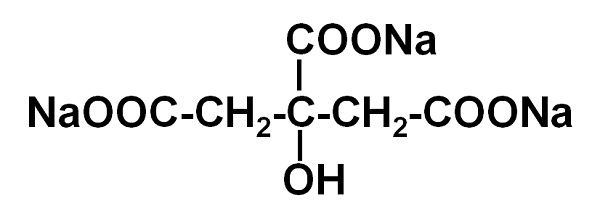
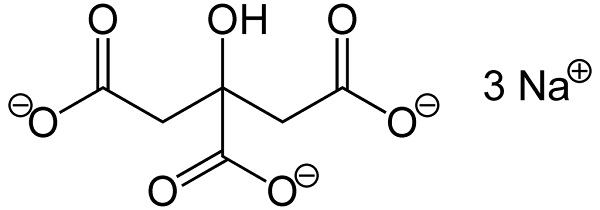
El citrato de sodio es la sal sódica del ácido cítrico. Está formada por un anión citrato C6H5O73– y tres cationes sodio Na+. Su fórmula molecular es C6H5O7Na3 o en su forma expandida: NaOOC-CH2-C(COONa)(OH)-CH2-COONa. El citrato de sodio es la base conjugada del ácido cítrico, es decir, se obtiene teóricamente de este último al sustituir cada protón H+ de –COOH por un sodio Na+.
Se puede preparar en forma anhidra (sin agua en su composición) o en su forma hidratada con 2 o 5 moléculas de agua. Es un compuesto que cuando está anhidro (sin agua) tiende a absorber agua del ambiente.
El citrato de sodio actúa como buffer, esto significa que estabiliza el pH, el cual es una medida de la acidez o basicidad de una solución acuosa. Además tiene la propiedad de formar un compuesto estable con iones calcio Ca2+, el citrato de calcio.
Se usa en la industria alimenticia, por ejemplo, para evitar que la leche de vaca forme grumos difíciles de digerir por los infantes.
En laboratorios de bioanálisis se emplea para evitar que coagule la sangre que se extrae a los pacientes para determinadas pruebas. También evita que coagule la sangre que se usa en transfusiones. Es muy utilizado en detergentes libres de fosfato porque no es contaminante.
Índice del artículo
El citrato de trisodio está formado por tres iones sodio Na+ y un ion citrato.
El ion citrato está conformado por una cadena de tres átomos de carbono a la cual están unidos 3 carboxilatos –COO– (uno por cada átomo de carbono) y un hidroxilo –OH en el carbono central.
Cada uno de los 3 iones Na+ está unido a un grupo –COO–.
– Citrato de sodio
– Citrato de trisodio
– 2-hidroxipropano-1,2,3-tricarboxilato de trisodio
Sólido blanco o incoloro cristalino.
258,07 g/mol
300 ºC
Es muy soluble en agua: 42,5 g/100 mL a 25 ºC. Es prácticamente insoluble en alcohol.
Una solución acuosa al 5% de citrato de sodio posee un pH entre 7,5 y 9,0, es decir, es ligeramente alcalina.
El citrato de sodio es un buffer, lo que significa que estabiliza el pH, el cual es una medida de la acidez o alcalinidad de una solución acuosa. El citrato al estabilizar el pH no permite que la solución se acidifique o alcalinice por encima de ciertos valores.
Cuando hay exceso de protones H+ los toma para convertir sus grupos –COO– en grupos –COOH. Viceversa, si hay muchos grupos OH– cede los protones de sus grupos –COOH y los convierte en –COO–.
Cuando es transformado por el organismo, proporciona 3 moléculas de HCO3– por cada molécula de citrato.
Sus cristales son delicuescentes, esto es, absorben agua del aire. El citrato de sodio dihidratado es más estable al aire.
Si se calienta el dihidrato, al llegar a 150 ºC se vuelve anhidro (sin agua).
Al igual que el ácido cítrico, el citrato de sodio tiene sabor agrio.
El citrato de sodio se obtiene usualmente añadiendo carbonato de sodio a una solución de ácido cítrico hasta que cesa la efervescencia. La efervescencia se debe al desprendimiento de dióxido de carbono CO2:
Na2CO3 + Ácido cítrico → Citrato de sodio + CO2↑
Luego se evapora el agua de la solución para cristalizar el producto.
También se puede preparar tratando una solución de sulfato de sodio con citrato de calcio:
Na2SO4 + Citrato de calcio → Citrato de sodio + CaSO4↓
La solución se filtra para eliminar el CaSO4 sólido que ha precipitado. Luego la solución se concentra y así cristaliza el citrato de sodio.
El citrato de sodio es la base conjugada del ácido cítrico, el cual es un compuesto natural encontrado en todos los organismos vivos pues forma parte de su metabolismo, que es el mecanismo para desarrollar energía en las células.
El citrato de sodio posee diversos usos en la industria de los alimentos, por ejemplo, como regulador de la acidez, secuestrante, estabilizador, agente surfactante o emulsionante.
Se emplea en bebidas, postres congelados y quesos especiales, entre otros productos.
Permite evitar la coagulación de la leche, por lo que se agrega a la leche de vaca que se usa para la alimentación de niños lactantes. De esta forma no se crean coágulos o cuajos duros difíciles de digerir por el estómago de los pequeños.

Se emplea para acelerar la fijación del color en carnes porcinas o vacunas curadas, es decir, carne tratada para evitar su descomposición. Se reemplaza hasta un 50% de ácido ascórbico en estas.

También sirve para prevenir la coagulación de la sangre en carne vacuna fresca (como los bisteces).
Se usa como agente alcalinizante, pues neutraliza el exceso de ácido en la sangre y la orina. Es indicado para tratar la acidosis metabólica que ocurre cuando el organismo produce demasiado ácido.
Una vez ingerido el ion citrato se convierte en ion bicarbonato el cual es un agente alcalinizante sistémico (o sea, de todo el organismo) y como consecuencia se neutralizan los iones H+, aumenta el pH de la sangre y se revierte o elimina la acidosis.
El citrato de sodio sirve como agente neutralizador para el malestar estomacal.
Se emplea como expectorante y sudorífico. Tiene acción diurética. Aumenta la excreción urinaria de calcio por lo que se usa en hipercalcemia, que es cuando hay un exceso de calcio en la sangre.
Sirve también para facilitar la eliminación de plomo cuando ocurre envenenamiento con este metal.
Si se administra en exceso puede producir alcalosis, espasmos musculares por malfuncionamiento de la glándula paratiroides y depresión de la función del corazón por disminución del nivel de calcio en sangre, entre otros síntomas.
El citrato de sodio se usa en las transfusiones. Se añade a la sangre junto con dextrosa para evitar su coagulación.
Normalmente el hígado metaboliza rápidamente el citrato obtenido en la transfusión, sin embargo, durante transfusiones de grandes cantidades, la capacidad del hígado puede excederse.
En tales casos dado que el citrato forma un complejo con el calcio, resulta una disminución del ion calcio Ca2+ en la sangre. Esto puede generar aturdimiento, temblores, hormigueo, etc. Por lo tanto las transfusiones deben realizarse lentamente.
Entre muchos otros usos se usa para prevenir el oscurecimiento de medicamentos en los que hay hierro y taninos.
Se emplea como anticoagulante en la recolección de sangre o cuando esta debe almacenarse, pues actúa como quelante de los iones calcio Ca2+, esto es, se une a los iones calcio formando citrato de calcio el cual no está ionizado.
Se usa en pruebas de coagulación y en la determinación de la velocidad de sedimentación de los glóbulos rojos.
Se usa como anticoagulante durante la plasmaféresis, procedimiento para extraer de la sangre exceso de sustancias nocivas para el organismo.
Se usa como estabilizador en la síntesis de nanopartículas de oro. Se añade el citrato de trisodio dihidratado a ácido cloroáurico, formándose una suspensión de color rojo vino.
El citrato de sodio sirve como agente reductor y como agente antiagregación, pues se adsorbe sobre las nanopartículas.
Debido a la carga negativa del citrato las partículas se repelen una con otra evitando aglomerarse y formando una dispersión estable. A mayor concentración de citrato más pequeñas son las partículas.
Estas nanopartículas sirven para preparar biosensores médicos.
El citrato de sodio es ampliamente utilizado en detergentes líquidos libres de fosfato. Esto se debe a que su comportamiento ambiental es inocuo pues es un metabolito hallado en todos los organismos vivos.
Es fácilmente biodegradable y débilmente tóxico para la vida acuática. Por esta razón se considera que es un agente de limpieza con características ecológicamente favorables.
Las arenas bituminosas son formaciones arenosas ricas en bitumen o alquitrán, un material similar al petróleo.
El citrato de sodio ha sido probado con éxito junto con el hidróxido de sodio NaOH para extraer el petróleo de arenas bituminosas.
Se piensa que al unirse el citrato con la arenisca, los iones –COO– del citrato forman una gran cantidad de cargas negativas sobre las partículas de sílice. Esto produce una mejor separación de la arena del bitumen por la simple repelencia de las cargas negativas de la grava de las cargas negativas del bitumen.
Se usa en fotografía, para remover metales traza, en electrodeposición y para remover SO2 de gases residuales.
- U.S. National Library of Medicine. (2019). Sodium citrate. Recuperado de: pubchem.ncbi.nlm.nih.gov.
- McNamara, C. (2017). Collection and Handling of Blood. In Dacie and Lewis Practical Haematology (Twelfth Edition). Recuperado de sciencedirect.com.
- Steber, J. (2007). The Ecotoxicity of Cleaning Product Ingredients. In Handbook for Cleaning/Decontamination of Surfaces. Recuperado de sciencedirect.com.
- Xiang, B. et al. (2019). Study of the Role of Sodium Citrate in Bitumen Liberation. Energy Fuels 2019, 33, 8271-8278. Recuperado de pubs.acs.org.
- Heddle, N. and Webert, K.E. (2007). Transfusion Medicine. In Blood Banking and Transfusion Medicine (Second Edition). Recuperado de sciencedirect.com.
- Sudhakar, S. and Santhosh, P.B. (2017). Gold Nanomaterials. In Advances in Biomembranes and Lipid Self-Assembly. Recuperado de sciencedirect.com.
- Elsevier (editorial) (2018). Chapter 8. Nanometal. In Fundamentals and Applications of Nano Silicon in Plasmonics and Fullerines. Current and Future Trends Micro and Nano Technologies. Pages 169-203. Recuperado de sciencedirect.com.
