Alilo: unidad alílica, carbocatión, radical, ejemplos
El alilo o 2-Propenilo es un grupo o sustituyente orgánico cuya fórmula estructural es CH2=CH-CH2-. Se compone de un fragmento vinílico, CH2=CH-, y de un grupo metileno, -CH2-. Consiste pues, de un grupo alquenilo, derivado específicamente del propeno, CH2=CH-CH3.
El término ‘alilo’ se debe al nombre botánico utilizado para referirse a los ajos: Allium sativum, de cuyos aceites en 1892 se aisló el compuesto dialilo de disulfuro, H2C=CHCH2SSCH2CH=CH2, responsable en parte de sus olores característicos. De hecho, muchos compuestos alílicos, es decir, aquellos que poseen el grupo alilo, se encuentran en ajos y vegetales.
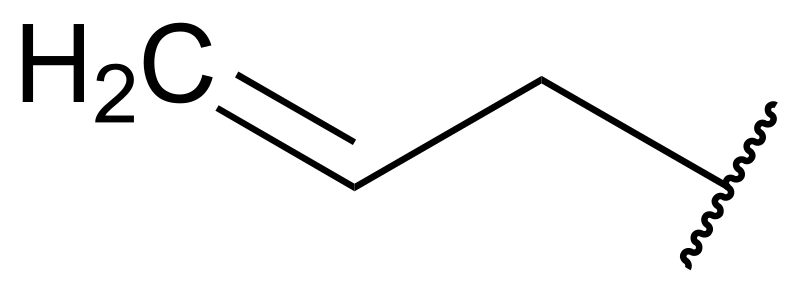
En la imagen superior se muestra la fórmula esqueletal del grupo alilo. Más allá de las sinuosidades de la derecha tenemos el resto de la molécula; si esta es alquílica, se representará con el símbolo R.
Es fácil reconocer el alilo porque se parece mucho al grupo vinilo. Sin embargo, el alilo también puede ser cíclico, pasando desapercibido en compuestos como el ciclopenteno.
Un ejemplo de un compuesto alílico es el alcohol alílico, H2C=CHCH2OH. Los hidrógenos del fragmento vinílico pueden estar substituidos y seguir siendo un alilo. Así, el 3-Metil-2-buten-1-ol, (CH3)2C=CHCH2OH, también es un alcohol alílico. Por lo tanto, es posible la existencia de los alilos cíclicos.
Índice del artículo
Más importante que el grupo alilo, es la unidad alílica la cual es la misma para todos los compuestos alílicos. Esta es: C=C-C. El extremo C=C corresponde a los carbonos vinílicos. Todos los átomos enlazados a estos dos carbonos recibirán asimismo el nombre de sustituyentes vinílicos. Por ejemplo, si son hidrógenos, CH2=CH, hablamos de hidrógenos vinílicos.
Mientras, por otra parte, el extremo -C corresponde al carbono alílico. Todos los átomos o grupos enlazados a este carbono se les llamarán sustituyentes alílicos. Por lo tanto, los compuestos alílicos precisamente son todos aquellos que poseen un grupo funcional (OH, S, F, COOH, etc.) enlazado al carbono alílico.
Los carbonos vinílicos tienen hibridación sp2, por lo que son más electronegativos que el carbono alílico, de hibridación sp3. Esta diferencia de electronegatividad incrementa la acidez de los hidrógenos alílicos, siendo probable la formación del carbanión alílico. Pero más provechoso en términos de síntesis orgánicas, es el carbocatión alílico, el cual se explicará abajo.
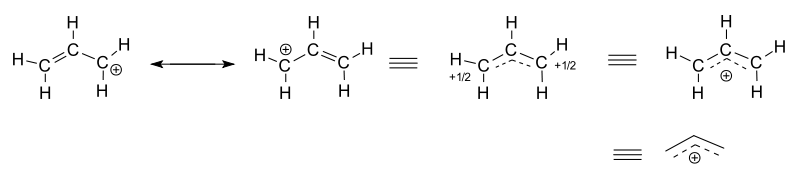
En la imagen superior se muestra el carbocatión alílico. Nótese que la carga positiva, (+), aparece primero sobre el carbono alílico. Sin embargo, inmediatamente los electrones del doble enlace se sentirán atraídos por dicha carga, por lo que se moverán en dirección del átomo de carbono alílico.
En consecuencia, tenemos dos estructuras de resonancia (izquierda de la imagen). Ahora, la carga positiva se sitúa sobre uno de los carbonos vinílicos. Nuevamente, los electrones del doble enlace del lado alílico volverán a sentirse atraídos por la carga positiva, y regresarán a su posición inicial. Esto se repite una y otra vez, a velocidades inimaginables.
El resultado: la carga positiva, +1, se deslocaliza o dispersa entre los tres átomos de la unidad alílica; pero concentrándose solamente en los dos carbonos de los extremos. Así, uno de los carbonos vinílicos conserva una carga de 1/2+, mientras que el carbono alílico se queda con la otra mitad de la carga, sumando +1.
Una manera más apropiada de representar el carbocatión alílico es mediante su híbrido de resonancia (derecha de la imagen). Así, se observa que la carga positiva se distribuye a lo largo de la unidad alílica.
La deslocalización de la carga positiva le confiere estabilidad el carbocatión alílico. Es tanto así, que se equipara con un carbocatión secundario en términos de estabilidad.
En la imagen, al tratarse solo de la unidad alílica, se asume que la distribución de la carga positiva es equivalente para ambos carbonos (+1/2 para cada uno). Pero esto no se cumple para todos los compuestos alílicos. Así, habrá carbocationes más o menos positivos; lo que significa, que serán más o menos reactivos.
Considérese por ejemplo el catión alilo:
H2C=CH-CH2+ ↔ H2C+-CH=CH2
Las dos estructuras de resonancia son equivalentes distribuyendo la carga positiva. No sucede igual, sin embargo, con el catión 1,1-dimetilalilo:
H2C=CH-C+(CH3)2 ↔ H2C+-CH=C(CH3)2
En la estructura de la izquierda, la carga positiva se ve más estabilizada por la presencia de los dos grupos metilos, los cuales donan parte de sus densidades negativas al carbono alílico.
Mientras, los hidrógenos vinílicos no aportan en sí nada a la carga positiva sobre el carbono vinílico. Por lo tanto, la estructura de la izquierda contribuirá más al híbrido de resonancia de este catión alílico.
Es crucial tener en mente que son los híbridos de resonancia los que más se aproximan al estado real de estos carbocationes, y no sus estructuras por separado.
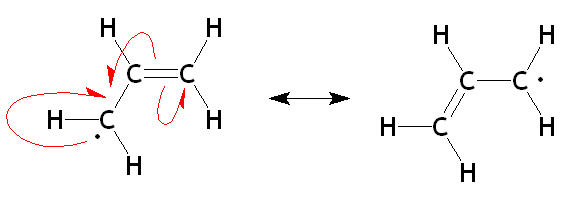
En la imagen superior se muestran ahora las dos estructuras de resonancia del radical alílico en su respectiva unidad alílica. Nótese que la naturaleza de su desarrollo es la misma que para el carbocatión: el electrón desapareado (·) se deslocaliza entre los dos carbonos de los extremos. Por lo tanto, cada uno tendrá “medio electrón” (1/2 ·).
Lo explicado para el carbocatión y el radical alílicos aplica también para su respectivo carbanión, donde cada uno de los dos átomos de carbono mencionados tendrá media carga negativa (-1/2).
Se mencionarán para finalizar varios ejemplos de compuestos alílicos. En cada uno de ellos estará presente la unidad alílica:
-Cloruro de alilo, H2C=CH-CH2-Cl
-Sulfuro de metilo alílico, H2C=CH-CH2-S-CH3 (otro de los compuestos responsables del olor de los ajos)
-Alicina, H2C=CH-CH2-S(O)-S-CH2-CH=CH2
-Alcohol crotílico, CH3CH=CH−CH2OH (nótese que uno de los hidrógenos vinílicos es sustituido por un metil)
-Acetato de alilo, H2C=CH-CH2-OC(O)CH3
-Bromuro de alilo, H2C=CH-CH2-Br
-Alilamina, H2C=CH-CH2-NH2 (unidad básica para alilaminas más complejas que se utilizan como anti fungicidas)
-Pirofosfato de dimetilalilo, (CH3)2C=CH-CH2-OPO2-O-PO3
En el siguiente par de alilaminas, flunarizina y naftifina, ambas con efectos farmacológicos, podremos apreciar el grupo alilo:
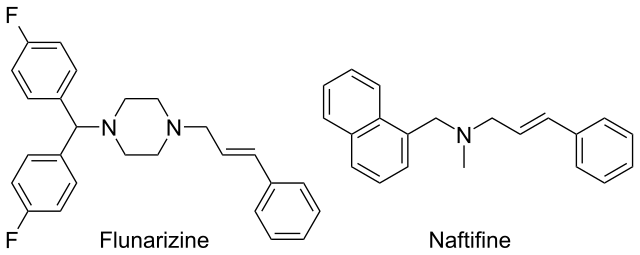
En ambas se encuentra a la derecha: ese doble enlace interpuesto entre los anillos de piperazina (el hexagonal con dos átomos de nitrógeno) y el bencénico. Nótese que para identificar el alilo es imprescindible recordar la unidad alílica: C=C-C, ya que esté en cadenas abiertas, o en estructuras cerradas.
- Morrison, R. T. y Boyd, R, N. (1987). Química Orgánica. 5ta Edición. Editorial Addison-Wesley Interamericana.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Wikipedia. (2020). Allyl group. Recuperado de: en.wikipedia.org
- Elsevier B.V. (2020). Allyl compound. ScienceDirect. Recuperado de: sciencedirect.com
- Gamini Gunawardena. (05 de junio de 2019). Allylic carbon. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
