Formas de balancear ecuaciones
Método algebraico de balanceo (con ejemplos)
El método algebraico de balanceo se utiliza en Química para igualar el número de átomos a ambos lados de una reacción química. Una reacción química escrita correctamente, debe tener las fórmulas de todos los reactivos participantes en el lado izquierdo y los productos, también con sus fórmulas, en el lado derecho.
Ahora bien, cuando se tiene una reacción, no siempre el número de átomos en las fórmulas de los reactivos iguala al de los respectivos átomos en las fórmulas de los productos.

Sin embargo, la masa se conserva. Por ejemplo veamos la siguiente reacción:
KClO3 → KCl + O2
Esta ecuación tiene a la izquierda un compuesto llamado clorato de potasio, el cual se descompone mediante calentamiento en cloruro de potasio y oxígeno gaseoso. Pero al observar con cuidado, notamos que en la molécula de clorato hay 3 átomos de oxígeno, mientras que a la derecha hay solamente una molécula de oxígeno gaseoso con 2 átomos.
Lo que se hace entonces es multiplicar por un coeficiente numérico al reactivo de la izquierda, de tal manera que la cantidad de átomos de todos los elementos participantes sea igual antes y después de la reacción.
Pero…¿cuál es el valor de este coeficiente?
Índice del artículo
- 1 Pasos para balancear algebraicamente una ecuación química
- 2 Ejemplos resueltos de balanceo
- 3 Referencias
Formas de balancear ecuaciones
En la ecuación anterior es fácil determinar los coeficientes apropiados mediante inspección. Si multiplicamos por 2 a la izquierda nos quedan 2 átomos de K, 2 de Cl y 6 de O.
Por lo tanto, a la derecha multiplicamos el cloruro de potasio por 2 y el O2 por 3:
2 KClO3 → 2KCl + 3O2
Y ahora podemos ver que la contabilidad es correcta a ambos lados de la flecha y la reacción quedó balanceada. Nótese que otros valores numéricos también pueden dar como resultado una ecuación balanceada, por ejemplo:
4 KClO3 → 4KCl + 6O2
Sin embargo, siempre se debe buscar el conjunto de números mínimos enteros que igualen la cantidad de átomos a ambos lados.
A los números que multiplican a cada fórmula se les llama coeficientes. Es muy importante notar que los coeficientes se pueden asignar para balancear, pero los subíndices deben permanecer tal cual aparecen en cada fórmula.
Tampoco se pueden intercalar coeficientes en medio de la fórmula de cada compuesto, puesto que lo alteraría.
Ecuaciones sencillas como la del ejemplo se pueden balancear por inspección o tanteo. Para las que son un poco más complejas hay un método algebraico con una serie de pasos simples y operaciones aritméticas elementales que se detallan a continuación.
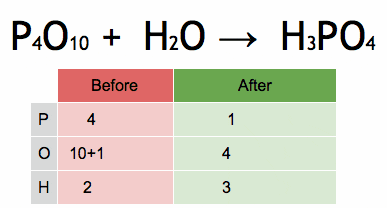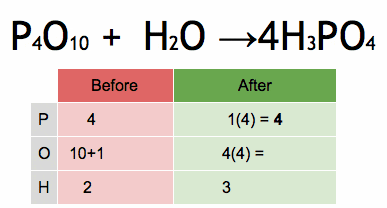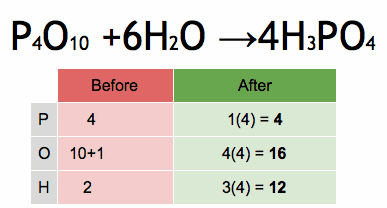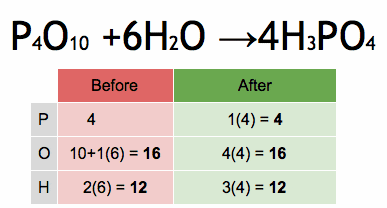
Paso 1
-Asignar a cada molécula un coeficiente arbitrario, simbolizado por una letra. Usualmente se emplean las letras a, b, c, d…., tantas como sean necesarias.
Importante: recordemos que solamente se emplea un coeficiente por molécula y nunca se intercala en medio de la misma, siempre se coloca a la izquierda.
Paso 2
-Hacer una lista de cada elemento participante.
Paso 3
-Colocar el o los coeficientes asignados a cada compuesto a la izquierda e igualar con los de la derecha. Si hay subíndices, se multiplican por el coeficiente para hallar el número total de átomos.
Y si algún elemento se encuentra en más de una molécula, se suman las cantidades de átomos presentes a cada lado. De esta forma se obtienen las ecuaciones parciales de cada elemento.
Paso 4
-Se le asigna un valor numérico a uno solo de los coeficientes. Usualmente este valor numérico es 1 y se le asigna a la letra que aparece más veces. Con esto se consigue una ecuación sencilla que sirve como punto de partida para encontrar los demás coeficientes.
Paso 5
-Determinar el valor del siguiente coeficiente mediante aritmética simple y reemplazar su valor en otra ecuación, para plantear una nueva.
Paso 6
-Repetir el paso anterior de reemplazar valores y crear una nueva ecuación, hasta encontrar todos los coeficientes.
Paso 7
-Sustituir los valores así determinados. Si dichos valores son enteros, hay que comprobar que la ecuación quedó balanceada. Si no resultaron enteros, se multiplica por el mínimo común múltiplo de los denominadores y se comprueba el balance.
Seguidamente vamos a visualizar la aplicación de estos pasos en la resolución de algunos ejemplos.
Balancear la siguiente reacción en caso de ser necesario, mediante el método algebraico:
N2O5 → N2O4 + O2
Solución
Observamos que la reacción no está balanceada, pues si bien hay 2 átomos de nitrógeno a ambos lados, con el oxígeno las cantidades a la izquierda y la derecha son diferentes.
Entonces debemos seguir los pasos descritos en la sección anterior:
-Escribimos de nuevo la ecuación y multiplicamos cada molécula por un coeficiente diferente. Se eligen letras minúsculas para que no se confundan con los elementos:
a⋅N2O5 → b⋅N2O4 + c⋅O2
-Ahora listamos cada elemento e igualamos las cantidades de dicho elemento a la izquierda y derecha. Estas son las ecuaciones parciales para cada elemento:
- a⋅N2 = b⋅N2
- a⋅O5 = b⋅O4 + c⋅O2
-Multiplicando el coeficiente y el subíndice obtenemos el número de átomos de nitrógeno. De la ecuación 1 obtenemos:
2a = 2b
-De la ecuación 2 se tienen 5a átomos de oxígeno a la izquierda, mientras que a la derecha hay 4b y 2c:
5a = 4b + 2c
-Asignamos el valor 1 al coeficiente a, de esta manera:
a = 1
Esta elección es arbitraria, también se pudo escoger primero b =1.
-Se sustituyen estos valores en la ecuación 2, para determinar el valor de c:
5 = 4 + 2c
2c = 5-4 = 1
c = ½
-Sustituimos los coeficientes en la ecuación original, el 1 no es necesario escribirlo de forma explícita:
N2O5 → N2O4 + ½ O2
-Ya que es preferible que los coeficientes sean enteros, se multiplica toda la ecuación por el mínimo común múltiplo de los denominadores, los cuales son 2 y 1:
m.c.m. (1,2) = 2
Entonces, al multiplicar a la izquierda y la derecha por 2, se obtiene:
2N2O5 → 2N2O4 + O2
Y contabilizamos el número de átomos a ambos lados, para comprobar el balance:
- N a la izquierda: 4
- O a la izquierda: 10
- N a la derecha: 4
- O a la derecha: 8 + 2 = 10
Balancear la siguiente reacción química:
NaHCO3 → Na2CO3 + H2O + CO2
Solución
Multiplicamos cada molécula por un coeficiente diferente:
a⋅NaHCO3 → b⋅Na2CO3 + c⋅H2O + d⋅CO2
Seguidamente planteamos la contabilidad de cada elemento a la derecha y a la izquierda de la flecha. Hay un total de 4 elementos en la reacción: sodio Na; hidrógeno H; carbono C y oxígeno O, todos deben contabilizarse:
- a⋅Na = b⋅Na2
- a⋅H = c⋅H2
- a⋅C = b⋅C + d⋅C
- a⋅O3 = b⋅O3+c⋅O+d⋅O2
De acuerdo a cada balance, se obtienen las siguientes ecuaciones:
1) a = 2b
2) a = 2c
3) a = b + d
4) a = 3b + c + 2d
El coeficiente que más se repite es a, por lo tanto le asignamos el valor 1:
a=1
Entonces:
1) a = 2b ⇒ b = ½
2) a = 2c ⇒ c = ½
3) a = b + d ⇒ d = a – b = 1 – ½ = ½
Sustituimos los coeficientes en la ecuación:
NaHCO3 → ½. Na2CO3 + ½. H2O + ½.CO2
Multiplicamos a ambos lados de la flecha por 2, ya que es el único denominador presente, para eliminar la fracción:
2NaHCO3 → Na2CO3 + H2O + CO2
Contabilizamos la cantidad de átomos presentes a la izquierda: 2 átomos de Na, H y C y 6 de O. El lector puede verificar que cada uno de ellos está presente también a la derecha en iguales cantidades.
- Atkins, P. Principios de Química: Los Caminos del Descubrimiento. Editorial Médica Panamericana. 3a Edición.
- Briceño, J. Guía de Química USB. Recuperado de: gecousb.com.ve.
- Chang, R. 2013. Química. 11va. Edición. Mc Graw Hill Educación.
- Ejercicios resueltos. Balanceo algebraico. Recuperado de: ejerciciosresueltos.co.
- Simoza, L. Balanceo de ecuaciones químicas. Recuperado de: guao.org.
