Regla de Hund o principio de máxima multiplicidad
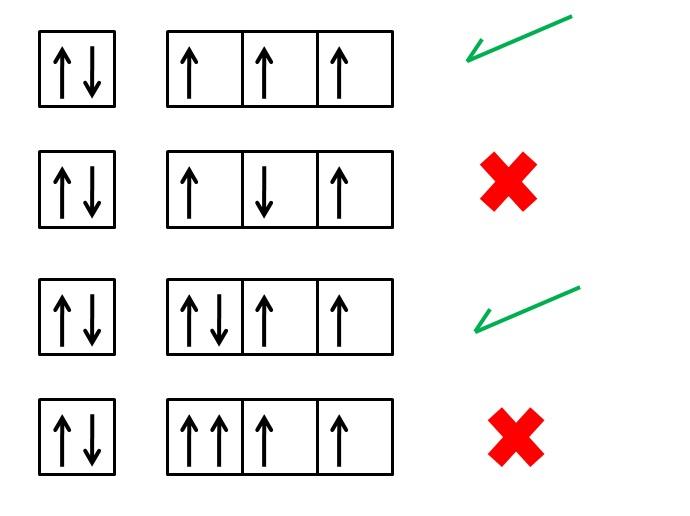
¿Qué es la regla de Hund?
La regla de Hund, también llamada principio de máxima multiplicidad de espín, es una regla empírica que se utiliza para escribir la configuración electrónica absoluta de los elementos químicos cuando estos están en su estado fundamental. Es decir, es una regla que ayuda a predecir cómo se distribuyen los electrones en los orbitales atómicos de un átomo que se encuentre relajado o en su menor nivel de energía.
La regla de Hund dice que:
“…en un átomo que se encuentra en su estado fundamental, los electrones de un mismo nivel de energía se distribuirán de forma tal que exista la mayor cantidad posible de espines paralelos”.
Esta regla corresponde a uno de los principios fundamentales de la mecánica cuántica y de la teoría atómica actual. Es de gran utilidad para comprender algunas propiedades de los distintos elementos, en especial sus propiedades magnéticas. Esto se debe a que los átomos son atraídos o repelidos por los imanes según tengan o no electrones desapareados en su estructura.
¿De dónde proviene la regla de Hund o de máxima multiplicidad?
Espectros atómicos
Este principio lo enunció por primera vez el físico alemán Friedrich Hund en 1927. Hund estudiaba espectros de absorción atómica, los cuales permiten medir experimentalmente la energía que absorben los electrones cuando se exponen a radiación electromagnética de longitud de onda adecuada. Las observaciones experimentales solo se podían explicar si el átomo poseía la mayor cantidad posible de electrones con el mismo espín.
Electrones desapareados
Además de los espectros atómicos, hay otras observaciones experimentales que confirman las configuraciones electrónicas que se predicen aplicando la regla de Hund. La más importante consiste en las medidas experimentales de las propiedades magnéticas de los átomos que permiten determinar cuántos electrones desapareados tiene un átomo.
Los electrones desapareados son aquellos que se encuentran solos en un orbital, sin su respectiva pareja de espín opuesto.
Pasos para aplicar la regla de Hund
La regla de Hund se aplica cuando escribimos la configuración electrónica de un átomo en su estado fundamental. Esto quiere decir que es una regla complementaria de otras reglas, tales como el principio de Aufbau o principio de construcción (también denominada la regla de la lluvia) y el principio de exclusión de Pauli.
Solamente aplica a aquellos casos en los que deseamos llenar los tres orbitales p, los cinco orbitales d o los siete orbitales f de un nivel de energía determinado.
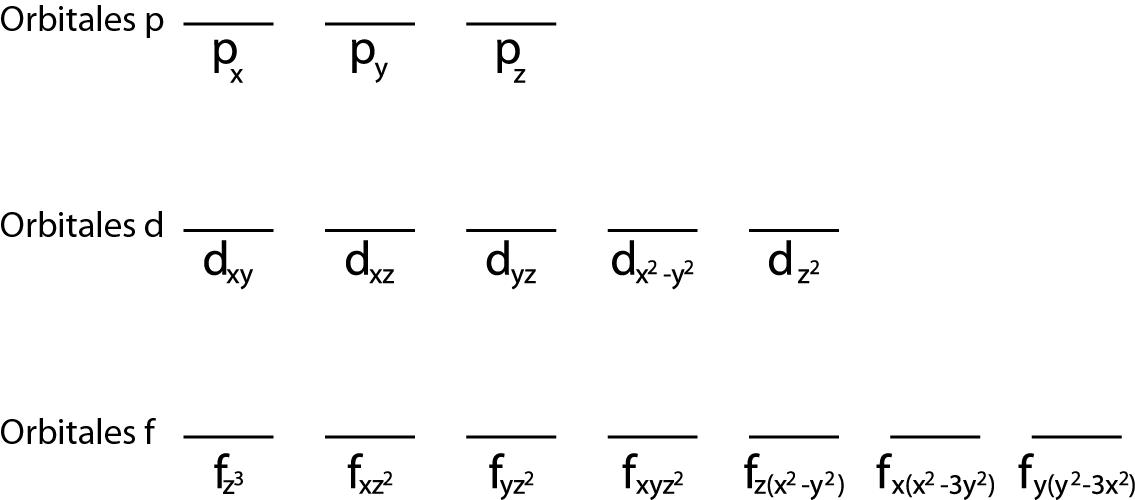
Además, solo tiene sentido aplicarla para la capa de valencia, es decir, aquel nivel de energía que está incompleto (no tiene todos los electrones que caben en él). De lo contrario, todos los electrones estarían apareados para poder cumplir con el principio de exclusión de Pauli.
La aplicación de esta regla consiste en los siguientes pasos:
- Paso 1: Dibujar una raya horizontal o un pequeño rectángulo para cada orbital del subnivel.
- Paso 2: Colocar el primer electrón en el primer orbital con su espín apuntando hacia arriba.
- Paso 3: Colocar el siguiente electrón en el siguiente orbital, también apuntando hacia arriba.
- Paso 4: Continuar así hasta que se acaben los electrones o ya no haya más orbitales vacíos.
- Paso 5: Si al colocar un electrón en cada orbital aún quedan electrones por repartir, repetir los pasos 2 al 4 pero colocando los electrones con su espín apuntando hacia abajo.
Para entender cómo se aplican estos pasos, analicemos un par de ejemplos.
Ejemplo 1: La configuración electrónica del nitrógeno
El nitrógeno es el elemento número 7, por lo que tiene en total 7 electrones girando alrededor del núcleo. Estos electrones están distribuidos de la siguiente manera, siguiendo la regla de la lluvia:
1s2 2s2 2p3
Como podemos ver, la capa de valencia del nitrógeno corresponde al nivel 2 de energía (que se llama capa L) en la cual caben 8 electrones. Sin embargo, el nitrógeno solo tiene 5 electrones de valencia.
En los orbitales s solo caben 2 electrones, así que el orbital 2s está completamente lleno y no tiene sentido aplicar la regla de Hund para este orbital.
En cambio, el subnivel 2p, que contiene 3 orbitales, no está lleno. Pero, ¿cómo se distribuyen estos 3 electrones en esos tres orbitales? Se distribuyen siguiendo los pasos de la regla de Hund, los cuales se presentan a continuación:
Paso 1: Dibujar una raya horizontal o un pequeño rectángulo para cada orbital del subnivel.
Como se trata del subnivel 2p, existen tres orbitales que son el 2px, 2py y el 2pz. Entonces, debemos dibujar tres rayas horizontales o tres cajitas o rectángulos:
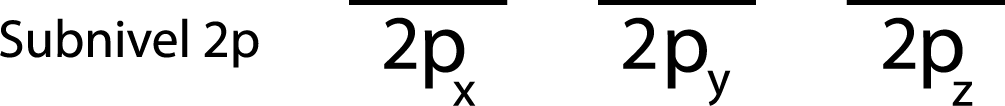
Cada una de estas rayas o cajitas representa a un orbital, como lo indica el nombre que tiene abajo cada una de ellas.
Paso 2: Colocar el primer electrón en el primer orbital con su espín apuntando hacia arriba.
Colocamos el primer electrón en el orbital 2px ya que este es el primer orbital de la lista.
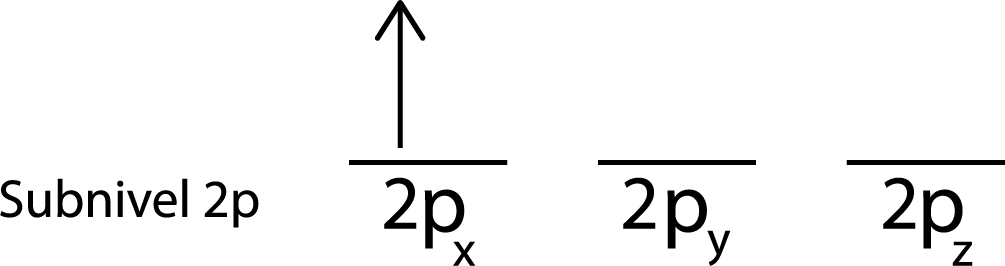
Paso 3: Colocar el siguiente electrón en el siguiente orbital, también apuntando hacia arriba.
El segundo electrón va ubicado en el orbital 2py
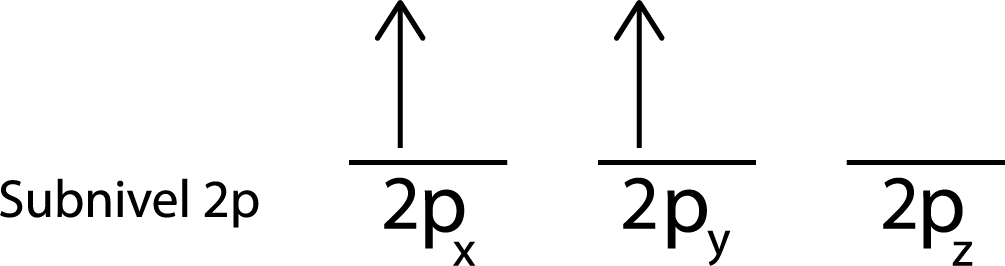
Paso 4: Continuar así hasta que se acaben los electrones o ya no haya más orbitales vacíos.
En nuestro caso, solo tenemos que repartir 3 electrones, así que solo nos falta colocar el último electrón en el último orbital y listo:
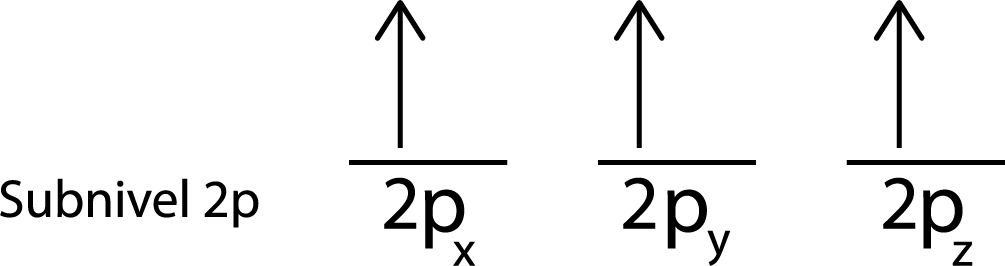
Como se puede ver, el principio de máxima multiplicidad o regla de Hund predice que el nitrógeno atómico debe tener 3 electrones desapareados.
En este caso, no fue necesario aplicar el paso 5, ya que luego del paso 4 nos quedamos sin electrones que repartir.
Ejemplo 2: La configuración electrónica del hierro
El hierro es el elemento 26 y su configuración electrónica es:
1s2 2s2 2p6 3s2 3p6 3d6 4s2
En este caso, podemos notar que el orbital con mayor nivel de energía es el 4s, pero por ser un metal de transición el hierro posee un orbital d parcialmente lleno. Este es el orbital cuyos electrones distribuiremos siguiendo la regla de Hund.
Paso 1: Dibujar una raya horizontal o un pequeño rectángulo para cada orbital del subnivel.
Llenaremos el subnivel 3d que contiene 5 orbitales:
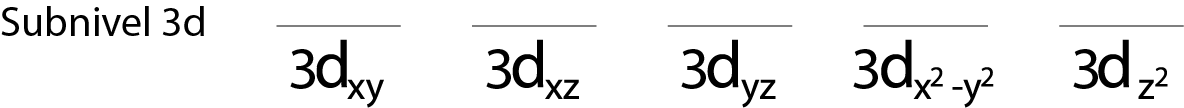
Paso 2: Colocar el primer electrón en el primer orbital con su espín apuntando hacia arriba.
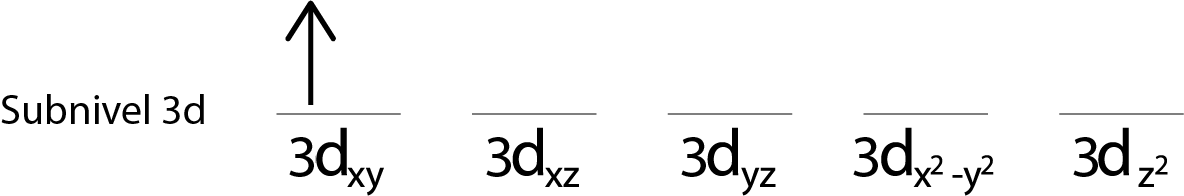
Pasos 3: Colocar el siguiente electrón en el siguiente orbital, también apuntando hacia arriba.
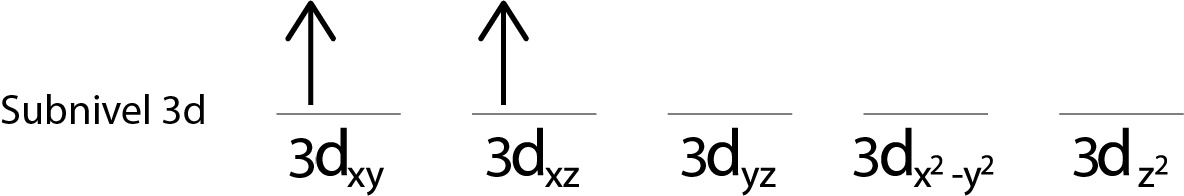
Paso 4: Continuar así hasta que se acaben los electrones o ya no haya más orbitales vacíos.
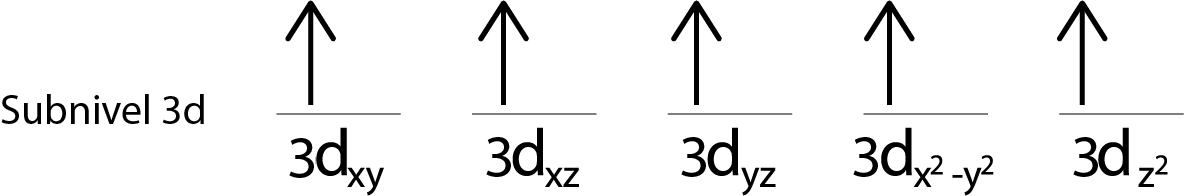
Paso 5: Si al colocar un electrón en cada orbital aún quedan electrones por repartir, repetir los pasos 2 al 4 pero colocando los electrones con su espín apuntando hacia abajo.
Como aún nos queda un electrón por repartir luego de colocar un electrón en cada orbital 3d, el último de los 6 electrones se coloca con el espín opuesto en el primer orbital.
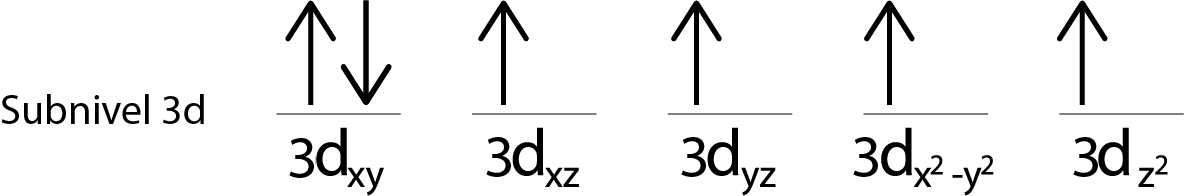
Esta es la configuración absoluta de un átomo de hierro en su estado fundamental. En el mismo, el hierro posee 4 electrones desapareados con espines paralelos.
Referencias
- Preguntas sin respuesta sobre el principio de máxima multiplicidad o regla de Hund: lo que se debe hacer (2020). Tomado de lafisicayquimica.com.
- Hund – Química (2021). Tomado de costsproject.org.
- Máxima multiplicidad de Hund (2020). Tomado de principiode.com.
- Regla de Hund | La Guía de Química (2012). Tomado de quimica.laguia2000.com.
