Peróxidos: propiedades, nomenclatura, usos, ejemplos
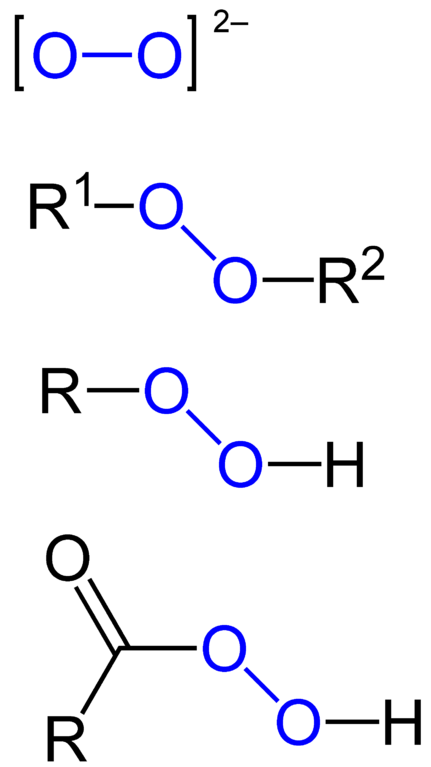
Los peróxidos son todos aquellos compuestos químicos que contienen el grupo peroxo, O-O, ya sea enlazado covalentemente a átomos de carbonos u otros grupos funcionales, o en forma iónica como el anión peróxido, O22-. Lo anterior se representa gráficamente en la imagen de abajo. En ella el grupo O-O se resalta con un color azul.
Puede haber peróxidos orgánicos tales como los diaquilperóxidos (R1-O-O-R2), los hidroperóxidos (R-O-O-H), los perácidos (RCO-O-O-H) y los perésteres (R1CO-O-O-R2). Asimismo, tenemos peróxidos inorgánicos, tales como los peróxidos metálicos (Mn+O22-) y el peróxido de hidrógeno (H-O-O-H). Este último es el más conocido de todos, recibiendo el nombre de agua oxigenada.
Todos los peróxidos comparten en común la propiedad de ser sustancias muy reactivas, oxidantes y, en algunos casos, explosivas. A menos que no se tenga precisado sintetizarlas, se les consideran impurezas indeseadas y peligrosas para muchos procesos industriales y para síntesis de laboratorio.
Los peróxidos en general son excelentes agentes oxidantes, blanqueadores, bactericidas, y activadores de polimerizaciones vía formación de radicales libres. Es por eso que suelen ser reactivos o aditivos muy útiles en la industria de los polímeros, así como en la industria alimenticia para acelerar oxidaciones y eliminar bacterias.
Índice del artículo
- 1 Propiedades de los peroxidos
- 2 Nomenclatura
- 3 Formación
- 4 Usos de los peróxidos
- 5 Ejemplos de peróxidos
- 6 Referencias
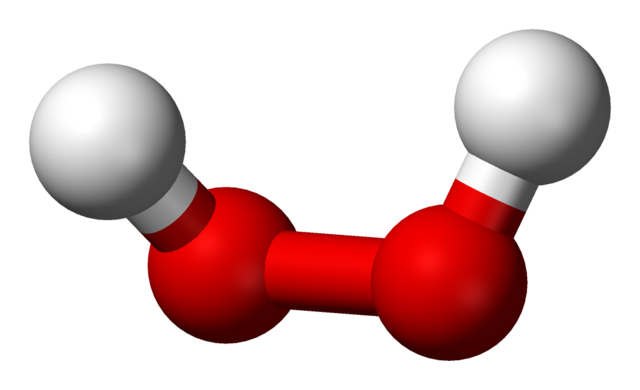
Las estructuras de los peróxidos se centran alrededor del grupo O-O. Cada átomo de oxígeno tiene una hibridación sp3, por lo que los enlaces -O-O- no descansan en un mismo plano. Por ejemplo, para el peróxido de hidrógeno, H-O-O-H, el ángulo formado entre los dos H es de 115.5º, lo cual demuestra que los cuatro átomos no están sobre un plano.
Las distorsiones de este y otros ángulos dependerán de la identidad de los demás fragmentos moleculares enlazados al grupo O-O.
Por otro lado, los peróxidos orgánicos e inorgánicos (a excepción de los metálicos) pueden reconocerse a simple vista si en su estructura se detalla el grupo O-O, como dos anteojos con una “boca”. De esta manera, se identifica de inmediato cualquier peróxido con un solo vistazo de su estructura.
El enlace O-O es relativamente débil comparado a otros enlaces tales como C-H o C-O. Es por eso que tiende a romperse o fragmentarse para producir radicales oxigenados altamente reactivos.
Son a causa de estos radicales que los peróxidos se clasifican como sustancias reactivas y peligrosas, pues pueden dañar los tejidos y cualquier materia orgánica en general.
Los peróxidos son poderosos agentes oxidantes, buscando ganar electrones del entorno para transformarse en agua, oxígeno o hidróxidos. Por ejemplo, el peróxido de hidrógeno es un agente oxidante más fuerte que el mismo permanganato de potasio.
Esta acción oxidante se aprovecha para detectarlos mediante su reacción con el sulfato ferroso y el tiocianato de potasio:
Peróxido + Fe2+ + SCN– → Fe(SCN)n(3-n)- (n= 1 a 6).
El complejo formado entre el Fe3+ y el SCN– es de color rojo sangre, por lo que la observación de este color corresponde a una prueba positiva para la presencia de peróxidos en la muestra.
Los peróxidos son sustancias sensibles a las altas temperaturas y a la luz solar. Por lo tanto, deben almacenarse en sitios seguros y dentro de recipientes plásticos y opacos, de tal manera que la luz no incida directamente sobre ellos.
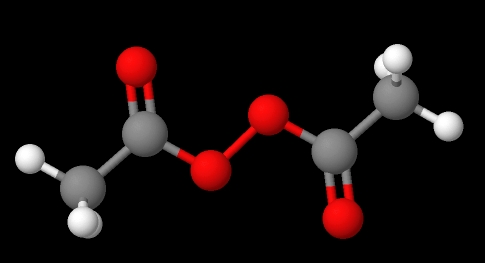
La nomenclatura de los peróxidos depende de a cuál tipo pertenecen. En general, muchos se nombran mencionando ‘peróxido de’ seguido de los sustituyentes R en orden alfabético. Por ejemplo, el compuesto CH3C(O)OOC(O)CH3 (imagen inferior) se llama peróxido de diacetilo o acetilo, pues posee un grupo acetilo en cada extremo.
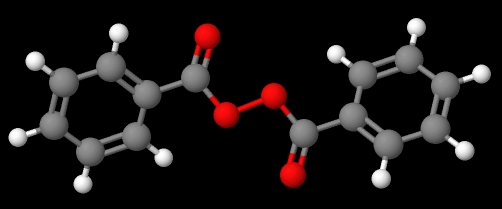
El compuesto C6H5C(O)OOC(O)C6H5 (imagen inferior), por otra parte, se llama peróxido de dibenzoílo o benzoílo, por las mismas razones expuestas en el párrafo anterior.
Mientras, el compuesto C6H5C(O)OOC(O)CH3 se llama peróxido de acetil benzoílo. Esta vez se menciona primero el sustituyente acetil por empezar con la letra ‘a’. Otro ejemplo es el CH3CH2OOC6H5, llamado peróxido de etil fenilo.
De manera similar, se procede con los hidroperóxidos. Por ejemplo, el CH3OOH se llama hidroperóxido de metilo.
Algunos peróxidos pueden formarse directamente por la exposición de la sustancia en cuestión con el oxígeno del aire, asistida o no con catalizadores metálicos. También pueden formarse exponiendo la sustancia al ozono bajo ciertas condiciones, llevándose a cabo la reacción de ozonólisis.
Otra ruta sintética consiste en hacer reaccionar el agua oxigenada con un alquilsulfato:
R2SO4 + H2O2 → R-O-O-R + H2SO4
Para poder así sintetizar o formar peróxidos dialquílicos o inclusive peróxidos cíclicos.
Mientras, varios de los métodos para formar los peróxidos metálicos se basan en oxigenar sus respectivos óxidos metálicos, de modo que se “oxigenen” y pasen de ser MO (Mn+O2-) a MO2 (Mn+O22-).
Los peróxidos, en especial los peróxidos orgánicos, se agregan a los medios de reacción para la síntesis de infinidades de plásticos y materiales tales como el poliestireno, la silicona, las resinas epóxicas y acrílicas, el cloruro de polivinilo, la fibra de vidrio, entre otros.
Esto se debe a que sufren descomposiciones térmicas para transformarse en radicales libres oxigenados, los cuales a su vez desencadenan y catalizan las polimerizaciones. Por lo tanto, son deseables en la industria de los polímeros.
Algunos de los peróxidos utilizados como iniciadores son el peróxido de metil etil cetona (MEK, por sus siglas en inglés), y el peróxido de acetona.
Los peróxidos son agentes blanqueadores, utilizados para el blanqueamiento de la pulpa de papel y de la harina. Asimismo, son agentes desinfectantes, totalmente eficaces aunque agresivos en lo que respecta a la exterminación de las bacterias. El ejemplo clásico corresponde al agua oxigenada, destinada en soluciones diluidas (3%) para desinfectar heridas.
Los peróxidos también son agentes oxidantes, por lo que encuentran muchos usos en las síntesis orgánicas de sustancias muy oxigenadas.
Aunque no esté entre sus principales usos, los peróxidos también pueden servir como fuentes de oxígeno en algunas de sus descomposiciones. Este es el caso, nuevamente, del agua oxigenada.
Para finalizar, se enlistarán algunos ejemplos de peróxidos, ya sean orgánicos o inorgánicos, con sus fórmulas y respectivos nombres:
-H2O2: peróxido de hidrógeno o agua oxigenada
-Na2O2: peróxido de sodio
-BaO2: peróxido de bario
-C6H5C(CH3)2OOH: hidroperóxido de cumeno
-(NH4)2S2O8: persulfato de amonio
– HO3SOOSO3H: ácido peroxidisulfúrico
-(CH3)3COOC(CH3)3: peróxido de ditert-butilo
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Organic peroxide. Recuperado de: en.wikipedia.org
- Elsevier B.V. (2020). Peroxide. ScienceDirect. Recuperado de: sciencedirect.com
- Advanced Chemistry Development. (s.f.). Alcohols, Phenols, and their Derivatives:
- Peroxides Rule C-218. Recuperado de: acdlabs.com
- Vol’nov I.I., Petrocelli A.W. (1966) Classification and Nomenclature of Inorganic Peroxide Compounds. In: Petrocelli A.W. (eds) Peroxides, Superoxides, and Ozonides of Alkali and Alkaline Earth Metals. Springer, Boston, MA.
