Solución insaturada: qué es, en qué consiste, ejemplos
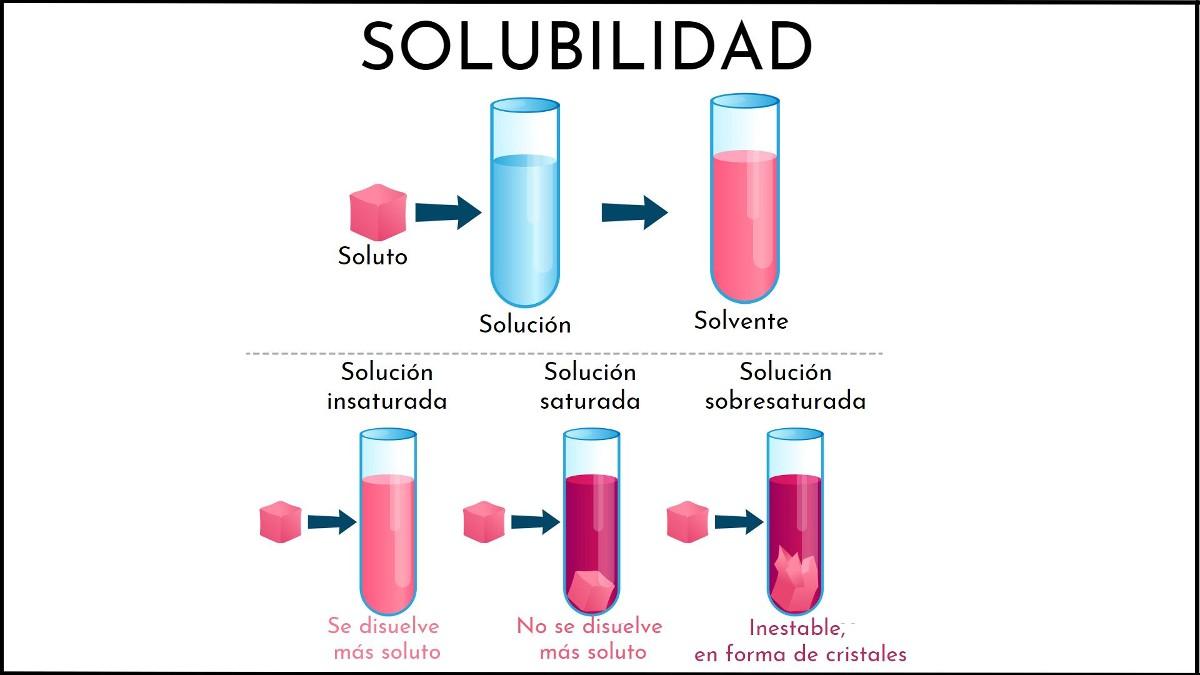
¿Qué es una solución insaturada?
Una solución insaturada es toda aquella solución en la cual el medio disolvente todavía es capaz de disolver más soluto. Este medio generalmente es líquido, aunque también puede ser gaseoso. Respecto al soluto, se trata de un conglomerado de partículas en estado sólido o gaseoso.
¿Y qué hay de los solutos líquidos? En dicho caso, la disolución es homogénea siempre y cuando ambos líquidos sean miscibles. Un ejemplo de esto es la adición de alcohol etílico al agua; los dos líquidos con sus moléculas, CH3CH2OH y H2O, son miscibles porque forman puentes de hidrógeno (CH3CH2OH— OH2).
Sin embargo, si se mezclara diclorometano (CH2Cl2) y agua, estos formarían una solución con dos fases: una acuosa y la otra orgánica. Esto es así porque las moléculas de CH2Cl2 y H2O interactúan muy débilmente, por lo que unas se deslizan sobre las otras, dando como resultado dos líquidos inmiscibles.
Una mínima gota de CH2Cl2 (soluto) basta para saturar el agua (solvente). Si, por el contrario, pudieran formar una solución insaturada, se vería entonces una disolución completamente homogénea.
Por esta razón, solamente los solutos sólidos y gaseosos pueden generar soluciones insaturadas.
¿En qué consiste una solución insaturada?
En una solución insaturada las moléculas de solvente interactúan con una efectividad tal que las moléculas de soluto no pueden formar otra fase.
Esto significa que las interacciones solvente-soluto superan, dadas las condiciones de presión y temperatura, las interacciones soluto-soluto.
Una vez aumentan las interacciones soluto-soluto, estas “orquestan” la formación de una segunda fase. Por ejemplo, si el medio disolvente es un líquido, y el soluto un sólido, el segundo se disolverá en el primero para formar una disolución homogénea, hasta que aparezca una fase sólida, la cual no es más que el soluto precipitado.
Este precipitado se debe a que las moléculas de soluto logran agruparse por su naturaleza química, intrínseca a su estructura o enlaces. Cuando esto sucede, se dice que la solución está saturada de soluto.
Por lo tanto, una solución insaturada de soluto sólido consiste en una fase líquida sin precipitado. Mientras que si el soluto es gaseoso, entonces una solución insaturada debe estar libre de la presencia de burbujas (que no son más que cúmulos de moléculas gaseosas).
Efecto de la temperatura
La temperatura influye directamente en el grado de insaturación de una solución respecto a un soluto.
Esto puedo deberse principalmente a dos razones: el debilitamiento de las interacciones soluto-soluto por efecto de calor, y el incremento de las vibraciones moleculares que ayuda a dispersar las moléculas de soluto.
Si se considera un medio disolvente como un espacio compacto en cuyos agujeros se alojan las moléculas de soluto, al aumentar la temperatura vibrarán las moléculas aumentando el tamaño de estos agujeros; de tal manera que el soluto puede abrirse paso en otras direcciones.
Sólidos insolubles
Sin embargo, algunos solutos presentan interacciones tan fuertes, que las moléculas de disolvente apenas son capaces de separarlos.
Cuando esto es así, una mínima concentración de dicho soluto disuelto es suficiente para que precipite, y se trata entonces de un sólido insoluble.
Los sólidos insolubles, al formar una segunda fase sólida que se diferencia de la fase líquida, generan pocas soluciones insaturadas.
Por ejemplo, si 1L del líquido A puede disolver únicamente 1g de B sin precipitar, entonces al mezclar 1L de A con 0.5 g de B generará una solución insaturada.
Del mismo modo, un rango de concentraciones que oscilen entre 0 y 1g de B también forman soluciones insaturadas. Pero al pasar de 1g, B precipitará. Cuando esto ocurre, la solución pasa de ser insaturada a saturada de B.
Si se somete a calentamiento una solución saturada con 1.5g de B, el calor ayudará a la disolución del precipitado. Sin embargo, si hay mucho B precipitado, el calor no podrá disolverlo.
De ser así, un aumento de la temperatura evaporaría sencillamente el solvente o al líquido A.
Ejemplos de solución insaturada
Los ejemplos de soluciones insaturadas son numerosos, ya que dependen del solvente y soluto. Por ejemplo, para un mismo líquido A, y otros solutos C, D, E… Z, sus disoluciones serán insaturadas siempre y cuando no precipiten o formen una burbuja (si son solutos gaseosos).
-El mar puede aportar dos ejemplos. El agua de mar es una disolución masiva de sales. Si se coloca a hervir un poco de esta agua, se notará que está insaturada ante la ausencia de sal precipitada. Sin embargo, a medida que se evapora el agua, los iones disueltos comienzan a agruparse, dejando salitre pegado a la olla.
-Otro ejemplo es la disolución de oxígeno en el agua de los mares. La molécula de O2 franquea las profundidades del mar lo suficiente para que respire la fauna marina, a pesar de que es poco soluble.
Por esta razón es común observar las burbujas de oxígeno emergiendo a la superficie; de las cuales, unas pocas moléculas logran disolverse.
Una situación similar ocurre con la molécula de dióxido de carbono, CO2. A diferencia del O2, el CO2 es ligeramente más soluble debido a que reacciona con el agua para formar ácido carbónico, H2CO3.
Diferencia con solución saturada
Resumiendo lo anterior recién explicado, ¿cuáles son las diferencias entre una solución insaturada y saturada? Primeramente, el aspecto visual: una solución insaturada consiste de una sola fase. Por lo tanto, no debe haber presencia de sólido (fase sólida) ni de burbujas (fase gaseosa).
Asimismo, las concentraciones de soluto en una solución insaturada pueden variar hasta que se forme un precipitado o una burbuja. Mientras que en las soluciones saturadas, bifásicas (líquido-sólido o líquido-gaseoso), la concentración de soluto disuelto es constante.
¿Por qué? Porque las partículas (moléculas o iones) que conforman el precipitado, establecen un equilibrio con las que yacen disueltas en el solvente:
Partículas del precipitado => partículas disueltas
Moléculas de la burbuja => moléculas disueltas
Este escenario no se contempla en las soluciones insaturadas. Al intentar disolver más soluto en una solución saturada, el equilibrio se desplaza a la izquierda; a la formación de más precipitado o burbujas.
Debido a que en las soluciones insaturadas todavía no se ha establecido este equilibrio (saturación) el líquido puede “almacenar” más sólido o gas.
Alrededor de un alga en el lecho marino hay oxígeno disuelto, pero cuando de sus hojas nacen burbujas de oxígeno, significa que ocurre una saturación del gas; de lo contrario, no se observarían burbujas.
Referencias
- Química General. Material de enseñanza. Lima: Pontificia Universidad Católica del Perú. Recuperado de: corinto.pucp.edu.pe
- Helmenstine, Anne Marie, Ph.D. (2018). Unsaturated Solution Definition. Recuperado de: thoughtco.com
- TutorVista (s.f.). Unsaturated Solution. Tomado de: chemistry.tutorvista.com
- Chemistry LibreTexts (s.f.). Types of Saturation. Recuperado de: chem.libretexts.org
- Nadine James. (2018). Unsaturated Solution: Definition & Examples. Recuperado de: study.com
