Arsénico: historia, estructura, propiedades, usos
El arsénico es un semimetal o metaloide que pertenece al grupo 15 o VA de la tabla periódica. Se representa mediante el símbolo químico As, y tiene por número atómico el 33. Puede encontrarse bajo tres formas alotrópicas: amarillo, negro y gris; siendo este último el único con importancia industrial.
El arsénico gris es un sólido de aspecto metálico, frágil, con un color acerado y cristalino (imagen inferior). Pierde su brillo al ser expuesto al aire formando el óxido arsenioso (As2O3), el cual al ser calentado emite un olor a ajo. Por otro lado sus alótropos amarillo y negro son moleculares y amorfos, respectivamente.

El arsénico se encuentra en la corteza terrestre asociado con numerosos minerales. Solamente una pequeña proporción se encuentra en estado nativo, asociado sin embargo al antimonio y a la plata.
Entre los minerales más comunes en los cuales se encuentra el arsénico están los siguientes: rejalgar (As4S4), el oropimente (As2S3), la loellingita (FeAs2) y la enargita (Cu3AsS4). También se obtiene arsénico como un producto colateral de la fundición de metales como el plomo, el cobre, cobalto y oro.
Los compuestos del arsénico son tóxicos, especialmente la arsina (AsH3). No obstante, el arsénico tiene numerosas aplicaciones industriales, entre ellas la aleación con el plomo, empleada en la elaboración de las baterías para automóviles, y la aleación con el galio con varios usos en la electrónica.
Índice del artículo
- 1 Historia de su descubrimiento
- 2 Estructura del arsénico
- 3 Configuración electrónica
- 4 Propiedades
- 4.1 Peso molecular
- 4.2 Descripción física
- 4.3 Color
- 4.4 Olor
- 4.5 Sabor
- 4.6 Punto de fusión
- 4.7 Densidad
- 4.8 Solubilidad en agua
- 4.9 Radio atómico
- 4.10 Volumen atómico
- 4.11 Radio covalente
- 4.12 Calor específico
- 4.13 Calor de evaporación
- 4.14 Electronegatividad
- 4.15 Energía de ionización
- 4.16 Estados de oxidación
- 4.17 Estabilidad
- 4.18 Descomposición
- 4.19 Auto-ignición
- 4.20 Dureza
- 4.21 Reactividad
- 5 Usos
- 6 ¿Dónde se encuentra?
- 7 ¿Cómo se obtiene?
- 8 Referencias
El nombre ‘arsénico’ proviene del latín arsenicum y del griego arsenikon, referidos al oropimente amarillo, el cual constituía la forma principal de uso del arsénico por los alquimistas.
El arsénico mucho antes de ser reconocido como un elemento químico, era conocido y usado bajo la forma de sus compuestos. Por ejemplo, Aristóteles en el siglo IV a.C. escribió sobre el sandarache, una sustancia que ahora se piensa que era el sulfuro de arsénico.
Plinio el Viejo y Pedanio Discórides, en el siglo I d.C., describieron el oropimente, un mineral constituido por As2S3. En el siglo XI, se reconocieron tres especies de arsénico: el blanco (As4O4), el amarillo (As2S3) y el rojo (As4S4).
El arsénico como elemento puro, fue observado por vez primera por Albertus Magnus (1250). Magnus calentó el sulfuro de arsénico con jabón, notando la aparición de una sustancia con una característica similar al alótropo grisáceo de la imagen. No obstante, el primer informe auténtico de su aislamiento fue publicado en 1649 por Johann Schroeder, un farmacéutico alemán.
Schroeder preparó el arsénico mediante el calentamiento de su óxido con carbón. Posteriormente, Nicolas Lémery logró producirlo al calentar una mezcla de óxido arsénico, jabón y potasa. En el siglo XVIII finalmente se reconoció a este elemento como un semimetal.
El arsénico es isomórfico al antimonio; esto es, estructuralmente son idénticos, difiriendo únicamente en el tamaño de sus átomos. Cada átomo de arsénico forma tres enlaces covalentes As-As, de tal manera que originan unidades hexagonales As6 “arrugadas o escarpadas”, ya que la hibridación de los átomos de As es sp3.
Entonces las unidades As6 se conectan dando lugar a capas escarpadas de arsénico, las cuales interaccionan débilmente entre sí. A raíz de sus fuerzas intermoleculares, dependientes sobre todo de sus masas atómicas, los cristales romboédricos de arsénico gris otorgan al sólido una textura frágil y quebradiza.
Debido posiblemente a las repulsiones del par libre de electrones del arsénico, las unidades As6 formadas entre capas paralelas no definen un octaedro perfecto sino distorsionado:
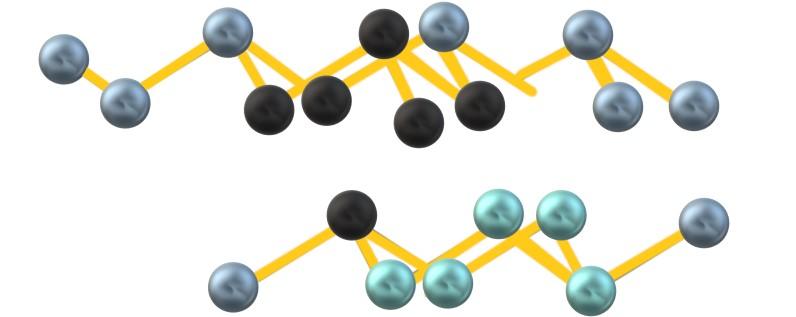
Nótese que las esferas negras dibujan el plano distorsionado en el espacio entre dos capas escarpadas. Asimismo, en la capa de abajo se tienen esferas azuladas las cuales, junto a la esfera negra, conforman la unidad As6 mencionada al principio del apartado.
La estructura luce ordenada, las hileras suben y bajan, y por tanto es cristalina. Sin embargo, puede tornarse amorfa, con esferas apretujadas de distintos modos. Cuando el arsénico grisáceo se vuelve amorfo, se transforma en un semiconductor.
El arsénico amarillo, el alótropo más tóxico de este elemento, es un sólido meramente molecular. Consiste de moléculas de As4 unidades por fuerzas débiles de dispersión, las cuales no evitan que se volatilicen.
El arsénico negro es amorfo; pero no como puede alcanzar a ser el alótropo grisáceo. Su estructura es ligeramente parecida a la recién descrita, con la diferencia de que sus planos de unidades As6 tienen mayores áreas y diferentes patrones de desorden.
[Ar] 3d104s24p3
Tiene todos los orbitales del nivel 3 llenos. Forma enlaces utilizando los orbitales 4s y 4p (al igual que el 4d) mediante diferentes hibridaciones químicas.
74,922 g/mol
El arsénico gris es un sólido grisáceo de aspecto metálico, y consistencia quebradiza.
Tres formas alotrópicas, el amarillo (alfa), el negro (beta) y el gris (gamma).
Inodoro
Insípido
1.090 K a 35,8 atm (punto triple del arsénico).
A presión normal no tiene punto de fusión, ya que sublima a 887 K.
-Arsénico gris: 5,73 g/cm3.
-Arsénico amarillo: 1,97 g/cm3.
Insoluble
139 pm
13,1 cm3/mol
120 pm
0,328 J/g·mol a 20 ºC
32,4 kJ/mol
2,18 en la escala de Pauling
Primera energía de ionización 946,2 kJ/mol
-3, +3, +5
El arsénico elemental es estable en el aire seco, pero cuando se expone al aire húmedo se recubre de una capa amarillo-bronce que puede devenir en una capa negra de óxido de arsénico (As2O3).
Cuando el arsénico es calentado a descomposición, emite un humo blanco de As2O3. El procedimiento es peligroso porque también puede emitirse la arsina, un gas muy venenoso.
180 ºC
3,5 en la escala de dureza de Mohs.
No es atacado por el ácido sulfúrico frío o ácido clorhídrico concentrado. Reacciona con el ácido nítrico o el ácido sulfúrico en caliente, formando el ácido arsenioso y el ácido arsénico.
Cuando el arsénico gris se volatiliza por calentamiento, y los vapores son rápidamente enfriados, se forma un arsénico amarillo. Este regresa a la forma grisácea, al ser sometido a la luz ultravioleta.
Una pequeña cantidad de arsénico añadido al plomo, endurece sus aleaciones lo suficiente para usarlas en el revestimiento de los cables, y en la elaboración de baterías para automóviles.
La adición de arsénico al latón, una aleación de cobre y cinc, aumenta su resistencia a la corrosión. Por otro lado, corrige o disminuye la pérdida del cinc en el latón, lo que provoca un aumento de su vida útil.
El arsénico purificado se utiliza en la tecnología de los semiconductores donde se usa en conjunción con el galio y germanio, así como en forma de arseniuro de galio (GaAs) que constituye el segundo semiconductor más utilizado.
Los GaAs tienen un intervalo de banda directo, que puede emplearse en la fabricación de diodos, láser y LED. Además del arseniuro de galio hay otros arseniuros, tales como el arseniuro de indio y el arseniuro de aluminio, los cuales también constituyen semiconductores III-V.
Mientras, el arseniuro de cadmio es un semiconductor del tipo II-IV. La arsina ha sido utilizada en el dopaje de semiconductores.
La mayoría de las aplicaciones han sido desechadas debido a su gran toxicidad y a la de sus compuestos. El As2O3 ha sido utilizado como pesticida, mientras el As2O5 es un ingrediente de herbicidas e insecticidas.
El ácido arsénico (H3AsO4) y las sales como arseniato de calcio y arseniato plomo, se han utilizado para esterilizar los suelos y controlar las plagas. Esto genera un riesgo de contaminación ambiental con arsénico.
El arseniato de plomo se usó como insecticida en los árboles frutales, hasta la primera mitad del siglo XX. Pero debido a su toxicidad, fue sustituido por el metilarsenato sódico, el cual dejó de usarse por la misma razón desde el año 2013.
Hasta el siglo XX se usaron varios de sus compuestos como medicamentos. La arsfenamina y el neolsalvarsan, por ejemplo, se utilizaron en el tratamiento de la sífilis y la tripanosomiasis.
En el año 2000, se aprobó el uso del As2O3, compuesto muy tóxico, en el tratamiento de la leucemia promielocítica aguda resistente al ácido retinoico todo-trans. Recientemente, se usó el isótopo radiactivo 74As para la localización de tumores.
El isótopo produce buenas imágenes, más claras que las obtenidas con el 124I, debido a que el yodo es llevado a la tiroides y produce ruido en la señal.
El arsénico se usó en el pasado como un aditivo del pienso en la producción de aves de corral y cerdos.
Es utilizado como catalizador en la manufactura de óxido de etileno. También es utilizado en la pirotecnia y en el bronceado. El óxido arsenioso se utiliza como decolorante en la fabricación del vidrio.
El arsénico puede encontrarse en pequeñas cantidades en estado elemental, con un alto grado de pureza. Se encuentra presente en numerosos compuestos, tales como: sulfuros, arsenuros y sulfoarseniuros.
También se encuentra en varios minerales, entre ellos: la arsenopirita (FeSAs), la loellingita (FeAs2), la enargita (Cu3AsS4), el oropimente (As2S3) y rejalgar (As4S4).
La arsenopirita se calienta a 650-700 ºC, en ausencia de aire. El arsénico se evapora, quedando como residuo el sulfuro de hierro (FeS). Durante este proceso el arsénico se une al oxígeno para formar As4O6, conocido como el “arsénico blanco”.
El As4O6 se modifica para formar el As2O3, cuyos vapores se recogen y condensan en un conjunto de cámaras de ladrillo, purificándose el arsénico mediante sublimación.
La mayor parte del arsénico se produce mediante la reducción por el carbono del polvo formado de As2O3.
- Stephen R. Marsden. (23 de abril de 2019). Chemistry of arsenic. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (03 de diciembre de 2018). Interesting Facts About Arsenic. Recuperado de: thoughtco.com
- Wikipedia. (2019). Arsenic. Recuperado de: en.wikipedia.org
- Dr. Dough Stewart. (2019). Arsenic element facts. Chemicool. Recuperado de: chemicool.com
- Royal Society of Chemistry. (2019). Arsenic. Recuperado de: rsc.or
- The Editors of Encyclopaedia Britannica. (03 de mayo de 2019). Arsenic. Encyclopædia Britannica. Recuperado de: britannica.com
