Electrodo de referencia: características, función, ejemplos
El electrodo de referencia es un dispositivo que se utiliza en análisis potenciométricos y voltamétricos para la determinación cuantitativa de un analito. Su importancia es, como su nombre indica, servir de referencia para estimar el verdadero valor del potencial en la reacción de una semicelda electroquímica.
Los potenciales de una semicelda dependen de la concentración de un ion en interés, dado que reacciona ganando o perdiendo electrones. De esta manera, es posible determinar su concentración mediante estos potenciales. Sin embargo, sus valores no son absolutos sino relativos al electrodo estándar de hidrógeno (SHE en inglés).
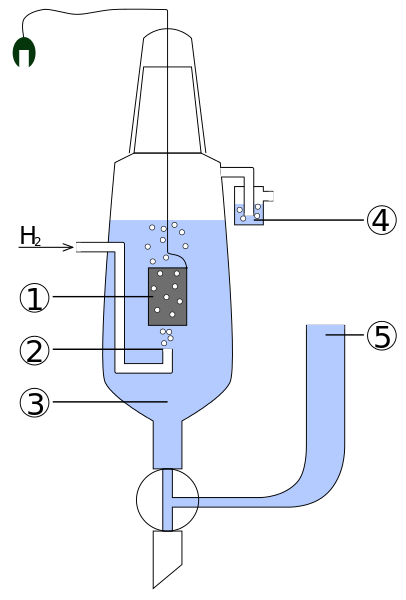
Por convención, los potenciales de los electrodos de hidrógeno (arriba) son iguales a 0V. El problema es que estos electrodos son difíciles de manipular, por lo que no resultan prácticos instalarlos en todos los análisis. Es aquí donde entran los electrodos de referencia, mucho más simples, y cuyos potenciales son distintos de 0V.
Algunos de los electrodos de referencia, como el electrodo saturado de calomel (ESC), se pueden construir en el mismo laboratorio antes de realizarse el análisis. Asimismo, se consiguen abiertamente en el mercado con sus debidas especificaciones, y los riesgos de que contaminen la muestra del analito son mínimos.
Índice del artículo
- 1 Características del electrodo de referencia
- 2 Función del electrodo de referencia
- 3 Ejemplos de electrodos de referencia
- 4 Referencias

Considérese el sistema de dos electrodos de arriba. Uno es el indicador (gris), donde transcurre la reacción de interés, y el otro es el de referencia (dorado). Esta celda electroquímica tendrá un potencial E, que será igual a la diferencia de los potenciales de ambos electrodos (Ei-Er). Por lo tanto, cualquier variación que haya en E debe deberse nada más al potencial del electrodo indicador.
De lo anterior se concluye que el electrodo de referencia posee las siguientes características:
-Tiene un potencial estable durante el tiempo y es reproducible. Es decir, debería ser el mismo sin importar dónde ni cuántas veces se hagan las mediciones.
-Su composición química es constante e insensible, por lo que apenas sufre cambios cuando interacciona con la solución del analito o se sumerge en un medio acuoso.
-Es fácil de construir y montar, a diferencia del electrodo estándar de hidrógeno, el cual demanda el uso de un tanque de hidrógeno y se corre riesgos de explosiones al mezclarse el hidrógeno con el aire.
El electrodo indicador es aquel que sí es sensible a la concentración del analito.
Los potenciales de los electrodos de referencia son medidos en contra del electrodo estándar de hidrógeno, por lo que sus valores son diferentes de 0V. Gracias a estos electrodos de hidrógeno es posible la construcción de las tablas de los potenciales estándar de reducción Eº, que aparecen en los índices de los textos de química para sinfines de reacciones redox.
No obstante, en la práctica no se anda cargando un electrodo de hidrógeno a todas partes. En su lugar, se utilizan los electrodos de referencia, mucho más simples y seguros de manipular.
Como sus potenciales son constantes y estables, las lecturas del potencial de la celda electroquímica se deberá exclusivamente al electrodo indicador; es decir, a las variaciones de concentración del analito en cuestión.
Así, la función del electrodo de referencia es la de determinar el potencial de una reacción cualquiera en una de las semiceldas del sistema electroquímico. Si sus potenciales no fueran estables, entonces las determinaciones cuantitativas del analito no serían confiables. Todo análisis potenciométricos o voltamétrico debe especificar qué electrodo de referencia utilizaron para reportar sus resultados.
Existen en el mercado varios diseños de electrodos de referencia disponibles. Algunos usados para determinaciones muy específicas. Sin embargo, hay dos electrodos entre todos ellos que sobresalen gracias a su sencillez y practicidad: el electrodo de calomel, y el de plata-cloruro de plata, ambos muy recurrentes en muchos análisis potenciométricos y voltamétricos.
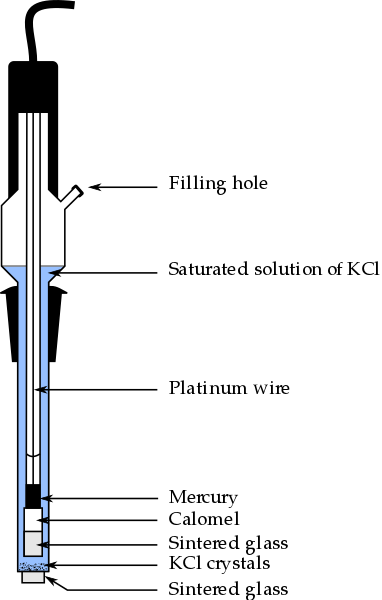
En la imagen superior se muestran las partes convencionales de un electrodo de calomel saturado, ECS. Se dice que está saturado porque contiene una solución saturada de KCl (azul), la cual presenta además cristales no disueltos de KCl.
La columna interna, recorrida por un alambre de platino, se llena con mercurio, el cual a su vez se pone en contacto con una pasta de calomel, Hg2Cl2 o cloruro de mercurio (I), y la solución saturada de KCl. Así pues, en este electrodo es importante la concentración de los iones Cl–, ya que su valor modifica el potencial del electrodo.
La reacción que toma lugar es la siguiente:
Hg2Cl2(s) + 2e− ⇌ 2Hg(l) + 2Cl−
Y tiene un Eº de 0.241 V.
En el extremo inferior del ECS hay una frita porosa, la cual se pone en contacto eléctrico con la solución del analito y permite el intercambio controlado de iones Cl–. De lo contrario, habría contaminación de cloruros en la muestra, y asimismo el electrodo perdería su preciada solución saturada de KCl.
Este electrodo se utiliza para mediciones de pH y en general de cualquier analito cuya concentración pueda determinarse en un medio acuoso.

Parecido al electrodo de calomel, el electrodo de plata-cloruro de plata consiste de un alambre de plata recubierto de cloruro de plata, y asimismo sumergido en una solución saturada por una mezcla de KCl y AgCl.
Todas sus partes se encuentran protegidas dentro de un tubo plástico, el cual tiene una abertura porosa a través de la cual establece el contacto eléctrico con la solución.
La reacción que define su potencial, Eº= 0.197 V, es la siguiente:
AgCl(s) + e− ⇌ Ag(s)+Cl−
Este electrodo presenta mayores usos y preferencias que el de calomel, lo cual se debe al impacto negativo que tiene el mercurio sobre el medio ambiente. Por otro lado, los electrodos de plata-cloruro de plata son más sencillos, seguros y baratos de construir en el laboratorio.
Decimos entonces que el electrodo de plata-cloruro de plata sustituye al de calomel en muchas de sus aplicaciones (titulaciones potenciométricas, pruebas de corrosión, análisis electroquímicos, etc.).
Es igualmente una de las opciones preferidas en biología y medicina, en especial a lo que respecta a la electrocardiografía y a la electroencefalografía, ya que la plata ni su sal son sustancias relativamente tóxicas para el organismo.
- Day, R., & Underwood, A. (1965). Química Analítica Cuantitativa. (quinta ed.). PEARSON Prentice Hall.
- Skoog D.A., West D.M. (1986). Análisis instrumental. (segunda ed.). Interamericana., México.
- Wikipedia. (2020). Reference electrode. Recuperado de: en.wikipedia.org
- Elsevier B.V. (2020). Reference electrode. ScienceDirect. Recuperado de: sciencedirect.com
- Chemistry LibreTexts. (09 de junio de 2020). Reference electrodes. Recuperado de: chem.libretexts.org
