Balanceo de ecuaciones químicas: ejemplos y ejercicios
¿Qué es el balanceo de ecuaciones químicas?
El balanceo de ecuaciones químicas es una operación matemática que se realiza para mantener la ley de la conservación de la materia en las reacciones. La materia no se crea ni se destruye. Por lo tanto, el número de átomos antes y después de una reacción química debe ser el mismo, tanto en los reactivos como en los productos.
Para balancear una ecuación química hay que contar los átomos antes y después de la flecha. Si los números coinciden, quiere decir que la reacción está balanceada. De lo contrario, será necesario igualar dichos números modificando los coeficientes estequiométricos mediante ensayo y error, siendo este el método más simple e intuitivo para los balanceos.
Cuando se balancea por ensayo y error es como si se quitaran o sumaran átomos en uno de los dos lados del subibaja. Hasta que el subibaja no esté suspendido en posición horizontal, la ecuación química no estará balanceada por completo. No puede haber más (crear materia) ni menos átomos (destruir materia) en ninguno de los lados.
Ejemplos fáciles de balanceo de ecuaciones
En los siguientes ejemplos se verán ecuaciones químicas balanceadas o fáciles de balancear. Todas deben tener en común que el número de átomos, para cada uno de los elementos, será el mismo antes y después de la flecha una vez se haya balanceado la ecuación química.
Oxidación del mercurio
2Hg + O2 → Hg2O2
Tenemos dos elementos: mercurio (Hg) y oxígeno (O). Expresamos el número de sus átomos antes (reactivos) y después (productos) de la flecha:
Hg: 2 (izquierda) — 2 (derecha)
O: 2 (izquierda) — 2 (derecha)
La ecuación está balanceada porque los átomos de Hg y O son iguales en ambos lados de la flecha.
Combustión del hidrógeno
H2 + O2 → H2O
Tenemos otra vez dos elementos: hidrógeno (H) y oxígeno (O). Repitiendo el paso anterior:
H: 2 — 2
O: 2 — 1
En el lado izquierdo sobra un oxígeno más que en el derecho. Debemos por lo tanto adicionar otro oxígeno a la derecha. Para ello, modificamos los coeficientes estequiométricos, que son los números que acompañan y anteceden a las fórmulas. Si colocamos un 2 delante del H2O nos dará:
H2 + O2 → 2H2O
H: 2 — 4
O: 2 — 2
Los oxígenos están balanceados. Pero no los hidrógenos. Hay que agregar dos hidrógenos ahora a la izquierda:
2H2 + O2 → 2H2O
H: 4 — 4
O: 2 — 2
Y la ecuación queda por fin balanceada: mismo número de H y O antes y después de la flecha.
Nótese que los coeficientes estequiométricos (2 para el H2 y 1 para el O2) multiplican los subíndices de las fórmulas. Esta multiplicación nos dará el número total de átomos para un elemento determinado.
Reducción del magnesio
Mg(NO3)2 + 2Li → Mg + 2LiNO3
Evaluamos los números de átomos para cada elemento:
Mg: 1 — 1
Li: 2 — 2
N: 2 — 2
O: 6 — 6
La ecuación química ya está balanceada y no hay necesidad de balancearla.
Ejercicios resueltos
Antes de proceder a balancear cualquier ecuación, siempre es necesario confirmar si no está ya balanceada. Dicho esto, procedemos con el siguiente ejercicio:
Ejercicio 1
¿Balanceada o no?
Fe2O3 + H2O → Fe(OH)3
Tenemos tres elementos: hierro (Fe), hidrógeno y oxígeno. Una sugerencia al momento de balancear ecuaciones es empezar contando los números de átomos del elemento menos abundante en la ecuación; que por lo general, es distinto a H y O. Así, contamos primero los átomos de Fe:
Fe: 2 — 1
El subíndice 3 del (OH)3 no multiplica al Fe de la izquierda. Para H y O tenemos:
H: 2 — 3
O: 4 — 3
Todos los elementos están desbalanceados.
Balanceo
Antes de siquiera balancear los H y O, debemos balancear los átomos de Fe: el elemento menos abundante, ya que apenas hay 3 Fe, a diferencia de los 5 H y 7 O. Hay que sumar, pues, un Fe a la derecha:
Fe: 2 — 2
Lo que es igual a poner un 2 como coeficiente estequiométrico delante del Fe(OH)3. La ecuación quedará como:
Fe2O3 + H2O → 2Fe(OH)3
Fe: 2 — 2
H: 2 — 6
O: 4 — 6
Pero los H y O siguen desbalanceados. Un H2O aporta 2 H y nos faltan 4 H. Por lo tanto, sumaremos otros dos H2O para que tengamos tres H2O:
Fe2O3 + 3H2O → 2Fe(OH)3
Y evaluamos de nuevo:
Fe: 2 — 2
H: 6 — 6
O: 6 — 6
Nótese cómo los O se balancearon por sí solos una vez balanceamos los H. La ecuación está finalmente balanceada.
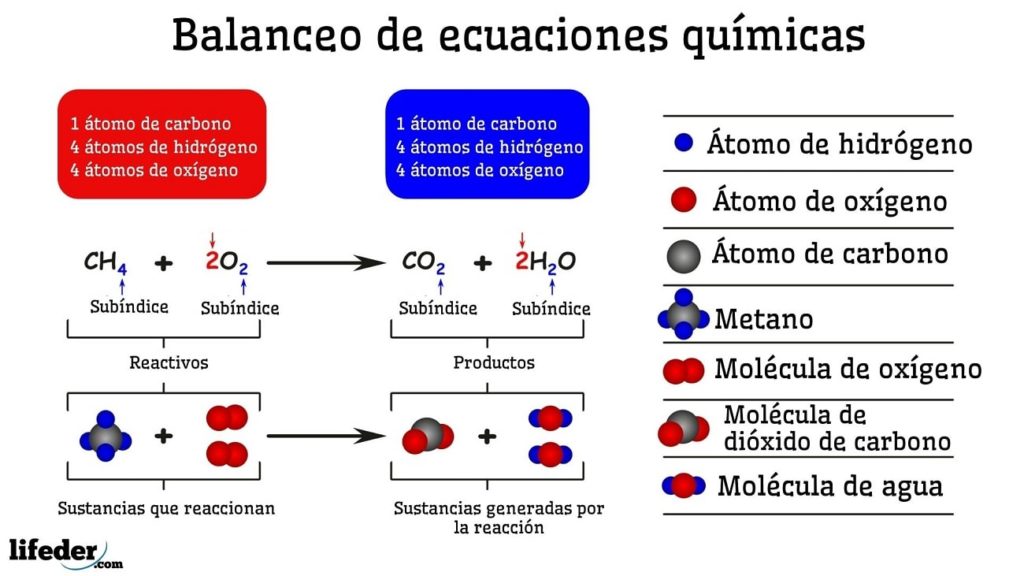
Ejercicio 2
¿Balanceada o no?
CH4 + O2 → CO2 + H2O
Evaluamos el número de átomos para todos los elementos presentes:
C: 1 — 1
H: 4 — 2
O: 2 — 3
El carbono está balanceado, pero no sucede lo mismo con el hidrógeno y oxígeno. La ecuación está desbalanceada.
Balanceo
Como el C está balanceado, no queremos modificar los coeficientes estequiométricos del CH4 o CO2. Al menos no en principio.
Enfocamos nuestra atención en H y O, especialmente en H. ¿Por qué? Porque viendo la ecuación resulta más sencillo balancear H antes que O. Necesitamos por lo tanto sumar 2 H a la derecha, colocando un coeficiente 2 delante del H2O:
CH4 + O2 → CO2 + 2H2O
C: 1 — 1
H: 4 — 4
O: 2 — 4
C y H están balanceados. Nos faltan 2 O a la izquierda. Si cada O2 aporta 2 O, adicionaremos entonces un O2 extra para que sean 4 O a la izquierda. Esto es igual a colocar un coeficiente 2 delante del O2:
CH4 + 2O2 → CO2 + 2H2O
C: 1 — 1
H: 4 — 4
O: 4 — 4
Y la ecuación queda finalmente balanceada.
Ejercicio 3
¿Balanceada o no?
N2 + H2 → NH3
Evaluamos para nuestros dos elementos N y H:
N: 2 — 1
H: 2 — 3
La ecuación no está balanceada.
Balanceo
Comenzamos balanceado el N, el elemento distinto a H. Nos falta un N a la derecha, y como cada NH3 aporta 1 N, debemos sumar otro NH3 para así tener 2 N:
N2 + H2 → 2NH3
N: 2 — 2
H: 2 — 6
Y ahora nos faltan H a la izquierda. Si cada H2 aporta 2 H a la ecuación, entonces deberemos sumar otros dos para que así haya 6 H. Esto es igual a colocar un coeficiente estequiométrico 3 delante del H2:
N2 + 3H2 → 2NH3
N: 2 — 2
H: 6 — 6
Y la ecuación química está finalmente balanceada.
Referencias
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Chemistry LibreTexts. (23 de noviembre de 2020). How to Write Balanced Chemical Equations. Recuperado de: chem.libretexts.org
- Wikipedia. (2020). Chemical equation. Recuperado de: en.wikipedia.org
- Principles of Chemistry. (s.f.). Writing and Balancing Chemical Equations. [PDF]. Recuperado de: web.ung.edu
- Phet. (s.f.). Balanceo de ecuaciones químicas. Recuperado de: phet.colorado.edu
- Armando Marín B. (s.f.). Química general: Balanceo de ecuaciones. [PDF]. Recuperado de: depa.fquim.unam.mx
