¿Qué es la cinética química?

¿Qué es la cinética química?
La cinética química es la rama de la química que se encarga de estudiar la velocidad de las reacciones químicas, qué factores afectan dicha velocidad y cuáles son los mecanismos o pasos individuales por medio de los cuales ocurren las reacciones químicas.
Además, permite comprender muchos aspectos de las reacciones químicas tales como el equilibrio químico y la energía de activación, y estudia los procesos de catálisis. Esto último la hace especialmente importante en múltiples aplicaciones, desde la bioquímica hasta la ingeniería industrial.
En el centro de la cinética se encuentra la velocidad de reacción, que se puede entender como la tasa a la cual los reactivos se transforman en productos. Sin embargo, en la cinética química se da una definición mucho más precisa.
Definición de la velocidad de reacción

En esta reacción, A y B representan los reactivos, C y D representan productos, mientras que a, b, c y d representan los respectivos coeficientes estequiométricos.
La velocidad de reacción (representada con el símbolo v) indica qué tan rápido se consumen los reactivos (A o B) o qué tan rápido se producen los productos (C o D) en una reacción química. Matemáticamente, esto se expresa de la siguiente manera:
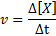
Donde Δ[X] representa el cambio en la concentración molar de la especie X (A, B, C o D) en el intervalo de tiempo Δt.
Es evidente que mientras más rápido se consuma cualquiera de los reactivos, más rápido se consumirán los demás reactivos y más rápido se producirán los productos. Por esta razón, solo hace falta definir la velocidad en términos de uno de ellos.
Para asegurar que el resultado del cálculo de la velocidad sea siempre el mismo, sin importar en función de cuál especie se defina la velocidad, se debe siempre dividir entre el coeficiente estequiométrico y colocar un signo menos antes de la ecuación si se trata de un reactivo. Es decir:
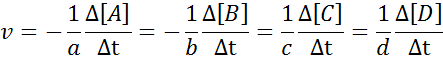
Ejemplo de definición de velocidad de reacción
Dada la siguiente reacción química:
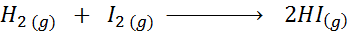
Escriba la definición de la velocidad de reacción en función de cada especie involucrada.
Solución:
En términos de H2:
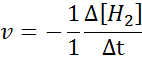
En términos de I2:
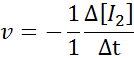
En términos de HI:
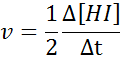
La ley de velocidad y el orden de reacción
Las reacciones ocurren cuando los átomos y moléculas chocan entre sí con suficiente energía y con la orientación adecuada. La probabilidad de que esto ocurra aumenta a medida que los átomos y moléculas están más concentrados.
Por esta razón, la velocidad casi siempre depende de la concentración de los reactivos. En algunos casos, la velocidad también depende de la concentración de alguno de los productos, así como de la concentración de cualquier catalizador o inhibidor que esté presente en el medio.
La ecuación matemática que relaciona la velocidad de una reacción con la concentración de las distintas especies involucradas se denomina “Ley de Velocidad” y, en los casos más sencillos, tiene la siguiente forma:
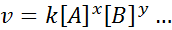
Donde k es una constante de proporcionalidad denominada constante de velocidad, y los exponentes de A, B y cualquier otra especie que aparezca en la ecuación, se denominan órdenes de reacción.
Según la suma de todos los órdenes de reacción (a lo que se le llama orden global), se pueden distinguir distintos tipos de reacciones. Estas se diferencian en qué tanto la concentración afecta la velocidad, en la fórmula del tiempo que tarda en consumirse la mitad de los reactivos (tiempo de vida media) y en la forma como cambia la concentración de los reactivos en el tiempo (las gráficas [A] vs t).
Reacciones de orden 0
Cuando todos los exponentes en la ley de velocidad son 0, la ecuación de la ley de velocidad queda reducida a:
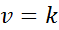
En otras palabras, son reacciones que ocurren a velocidad constante y en las que la velocidad no depende de la concentración de ningún reactivo o producto.
Gráficas de orden 0
La gráfica de [A] vs t de las reacciones de orden 0 son líneas rectas descendentes.
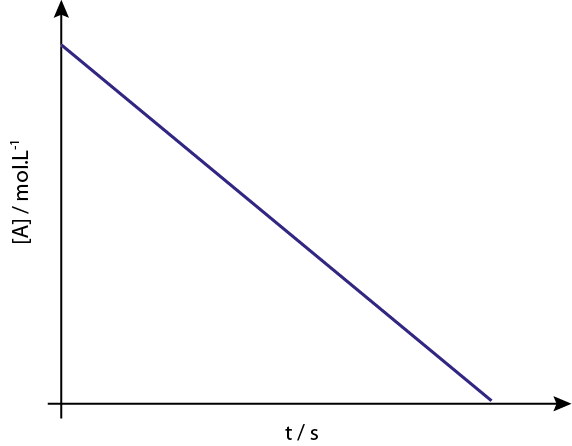
LEYENDA: La gráfica de concentración vs tiempo de una reacción de orden 0 da una línea recta.
Tiempo de vida media para orden 0
Para una reacción de orden 0, el tiempo de vida media (t1/2) viene dado por:
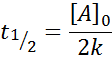
Reacciones de 1er orden
En estas reacciones la velocidad varía linealmente con la concentración. La ley de velocidad de primer orden es:
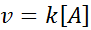
Gráficas de primer orden
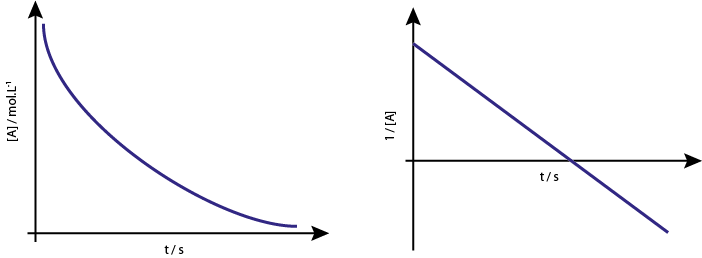
La gráfica de [A] vs t de las reacciones de primer orden son hipérbolas descendentes. Sin embargo, si se grafica el logaritmo neperiano de la concentración (ln[A]) vs tiempo, se obtiene una línea recta.
Tiempo de vida media para reacciones de primer orden
Para una reacción de orden 1, t1/2 no depende de la concentración inicial y viene dado por:
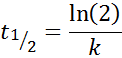
Reacciones de segundo orden
Una reacción puede ser de segundo orden respecto a un solo reactivo, o de primer orden respecto a dos reactivos. En el primer caso, la ley de velocidad viene dada por:
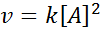
Gráficas de segundo orden
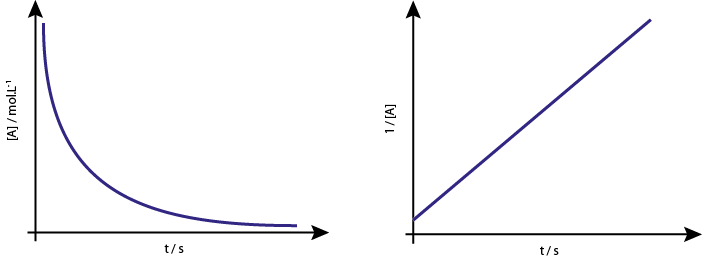
La gráfica de [A] vs t de las reacciones de segundo orden son hipérbolas descendentes. Sin embargo, si se grafica el inverso de la concentración (1/[A]) vs tiempo, se obtiene una línea recta.
Tiempo de vida media para reacciones de segundo orden
Para una reacción de orden 2, t1/2 viene dado por:
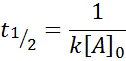
Factores que afectan a la velocidad de reacción
Temperatura
La temperatura siempre aumenta la velocidad a la que ocurren las reacciones, ya que aumenta la frecuencia y la energía con la que las moléculas chocan entre sí. La dependencia de la velocidad de reacción con la temperatura viene dada por la ecuación de Arrhenius.
Presión
Aumentar la presión es equivalente a aumentar la concentración de todas las especies en el medio de reacción (para reacciones en fase gaseosa), así que los aumentos de presión tienden a aumentar la velocidad de las reacciones.
Catalizadores
Los catalizadores son sustancias químicas que se agregan al medio justamente para aumentar la velocidad de reacción. La mayoría de los catalizadores funcionan cambiando el mecanismo de reacción por uno que requiere una menor energía de activación.
Ejemplos comunes de catalizadores son las enzimas en los sistemas vivos y algunos metales como el platino y el paladio.
Inhibidores
Los inhibidores son lo contrario de los catalizadores. Son sustancias que hacen que las reacciones ocurran más lentamente. Los anticorrosivos son ejemplos de inhibidores que buscan disminuir la velocidad de las reacciones de corrosión, para lograr que las superficies metálicas duren más.
