Reactivo de Benedict: para qué sirve, componentes, preparación
El reactivo de Benedict es una disolución azulada de cobre que se utiliza para detectar la presencia de azúcares reductores: aldehídos, alfa-hidroxi-cetonas y hemicetales. Fue desarrollado por Stanley R. Benedict (1884-1936).
Los azúcares alfa-hidroxi-cetonas se caracterizan por poseer un grupo hidroxilo en la adyacencia de la cetona. Mientras, un hemicetal es un compuesto que resulta de la adición de un alcohol a un aldehído o cetona. El reactivo de Benedict reacciona indiscriminadamente con todos estos azúcares reductores.
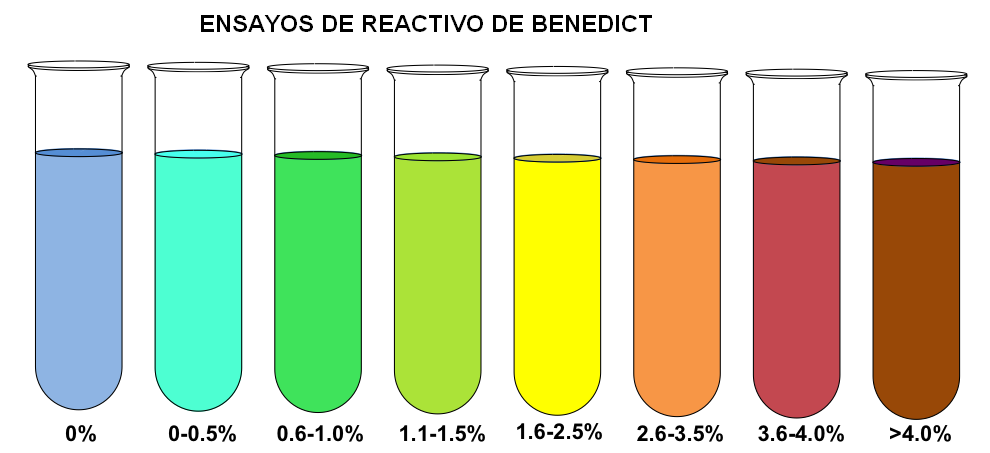
El método de Benedict está basado en la acción reductora de los azúcares sobre el Cu2+, de coloración azul, que lo transforma en Cu+. El Cu+ forma un precipitado rojo-ladrillo de óxido cuproso. No obstante, dependiendo de la concentración de los azúcares van apareciendo un espectro de colores (imagen superior).
Nótese que si se añade el reactivo de Benedict a un tubo de ensayo sin azúcares reductores (0%), este no experimenta cambio alguno de su coloración azulada. Así, cuando la concentración es superior a 4%, el tubo de ensayo se tiñe de un color pardo.
Índice del artículo
- 1 Historia
- 2 ¿Para qué sirve el reactivo de Benedict?
- 3 Componentes
- 4 Procedimiento de uso
- 5 Reacción del test de Benedict
- 6 Preparación del reactivo de Benedict
- 7 Referencias
El reactivo fue creado por el químico estadounidense Stanley Rossiter Benedict en 1909, quien publicó su artículo científico A reagent for detection of reducing sugars, en la revista J. Biol. Chem.
Además, Lewis y Benedict (1915) publicaron un método para la determinación de azúcares reductores en sangre, usando como indicador al picrato; pero dejó de usarse debido a su falta de especificidad.
El reactivo de Benedict es muy parecido al de Fehling. Se diferencian en que Benedict utiliza el ion citrato y la sal carbonato de sodio; mientras Fehling emplea el ion tartrato e hidróxido de sodio.
La prueba de Benedict es cualitativa, es decir, solo detecta la presencia de azúcares reductores. Sin embargo, el reactivo de Benedict puede ser cuantitativo si posee tiocianato de potasio en solución, el cual forma un precipitado blanco de tiocianato de cobre que puede ser valorado mediante el uso de patrones de glucosa.
El reactivo de Benedict todavía es utilizado para detectar la presencia de glucosa en la orina y es un indicio de la enfermedad de diabetes en el paciente, cuya orina es sometida a la prueba o test de Benedict. Aunque, no puede descartarse que la glucosuria tenga un origen distinto.
Por ejemplo, se encuentra la glucosuria aumentada en condiciones tales como: embarazo, glucosuria renal primaria, acidosis tubular renal, Síndrome de Fanconi primario o secundario, hiperaldosteronismo y pancreatitis aguda o cáncer de páncreas.
El reactivo de Benedict es de coloración azul debido a la presencia de Cu2+, el cual es reducido a Cu+ por la acción de los azúcares reductores; en este caso, la glucosa, formándose un precipitado de óxido de cobre (I) de color rojo ladrillo.
La coloración y la formación del precipitado en la prueba de Benedict aplicada a la orina varía en función de la concentración del azúcar reductor. Si la concentración de glucosa en la orina es menor a 500 mg/dL, la solución adquiere una coloración verde y no hay formación de precipitado.
La concentración de glucosa en la orina de 500 – 1.000 mg/dL origina un precipitado de color verde en la prueba de Benedict. A una concentración mayor de 1.000 a 1.500 mg/dL, provoca la formación de un precipitado amarillo.
Si la concentración de glucosa es de 1.500 – 2.000 mg/dL, se verá la formación de un precipitado anaranjado. Por último, una concentración de glucosa en orina es mayor a 2.000 mg/dL, provocará la formación de un precipitado de color rojo ladrillo.
Esto señala que la prueba de Benedict tiene un carácter semicuantitativo y se Reporta el resultado recurriendo a cruces. Así por ejemplo, a la formación de un precipitado verde le corresponde una cruz (+); y a la formación de un precipitado rojo ladrillo, le corresponden cuatro cruces (++++).
El reactivo de Benedict detecta la presencia de azúcares reductores que poseen un grupo funcional libre o un grupo funcional cetona libre, como parte de su estructura molecular. Este es el caso de glucosa, galactosa, manosa y fructosa (monosacáridos), así como la lactosa y la maltosa (disacáridos).
La sacarosa y el almidón no reaccionan con el reactivo de Benedict por tener grupos reductores libres. Además, hay compuestos que interfieren en la prueba de Benedict en la orina, dando falsa positividad; tal es el caso del salicilato, penicilina, estreptomicina, levodopa, ácido nalidíxico e isoniazida.
Hay químicos presentes en la orina que pueden reducir la reacción de Benedict; por ejemplo: la creatinina, el urato y el ácido ascórbico.
Los componentes del reactivo de Benedict son los siguientes: sulfato de cobre pentahidratado, carbonato de sodio, citrato trisódico y agua destilada.
El sulfato de cobre pentahidratado, CuSO4·5H2O, contiene el Cu2+: es el compuesto que le da la coloración azul al reactivo de Benedict. Los azúcares reductores actúan sobre el Cu2+, produciendo su reducción a Cu+ y la formación de un precipitado de óxido cuproso (Cu2O) de color rojo ladrillo.
El carbonato de sodio genera un medio alcalino, necesario para que se dé la reducción del cobre. El carbonato de sodio reacciona con el agua, generando bicarbonato de sodio y el ion hidroxilo, OH–, responsable de la alcalinidad del medio necesaria para que se produzca el proceso reductivo.
El citrato de sodio forma un complejo con el cobre (II) que evita que este experimente durante su almacenamiento una reducción a Cu (I).
Se colocan 5 mL del reactivo de Benedict en un tubo de ensayo 20 x 160 mm y se le agrega 8 gotas de orina. Se agita suavemente el tubo de ensayo y se coloca en un recipiente con agua hirviendo durante 5 – 10 minutos.
Transcurrido este tiempo, se saca el tubo del baño de agua caliente y se enfría su superficie con agua corriente para tener finalmente la lectura del resultado obtenido al realizar el test de Benedict (los colores).
La reducción del Cu (II) durante el test de Benedict se puede esquematizar en la forma siguiente:
RCHO + 2 Cu2+ (en complejo) + 5 OH– => RCOO– + Cu2O + 3 H2O
RCHO = aldehído; RCOO– = (ion carboxilato); Cu2O = óxido cuproso, un precipitado de color rojo ladrillo.
Se pesan 173 gramos de citrato sódico y 100 gramos de carbonato de sodio y se disuelven conjuntamente en 800 mL de agua destilada tibia. Si se observa restos de las sustancias no disueltas, debe filtrarse la solución.
Por otro lado, se disuelven 17,3 gramos de sulfato cúprico pentahidratado en 100 mL de agua destilada.
Posteriormente, se mezclan suavemente las dos soluciones acuosas y se continúa con agitación permanente, completándose a 1.000 mL con agua destilada.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. Amines. (10th edition.). Wiley Plus.
- Clark J. (2015). Oxidation of aldehydes and cetones. Recuperado de: chemguide.co.uk
- Wikipedia. (2020). Benedict’s reagent. Recuperado de: en.wikipedia.org
- Editorial team. (09 de enero de 2019). Benedict’s Test : Principle, Reagent Preparation, Procedure and Interpretation. Recuperado de: laboratoryinfo.com
- Dr. Whitson. (s.f.). Benedict’s reagent: A Test for Reducing Sugars. Recuperado de: nku.edu
