Constante de ionización: qué es, ecuación y ejercicios
¿Qué es la constante de ionización?
La constante de ionización, constante de disociación o constante de acidez, es una propiedad que refleja la tendencia de una sustancia para liberar iones hidrógeno. Es decir, guarda relación directa con la fuerza de un ácido.
Mientras mayor sea el valor de la constante de disociación (Ka), mayor será la liberación de hidrogeniones por el ácido.
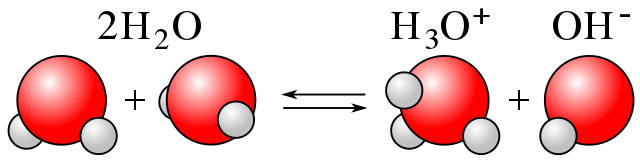
Cuando se trata del agua, por ejemplo, su ionización se conoce con el nombre de ‘autoprotólisis’ o ‘autoionización’.
Aquí, una molécula de agua cede un H+ a otra, produciéndose los iones H3O+ y OH–, tal como se aprecia en la imagen superior.
La disociación de un ácido de una disolución acuosa puede esquematizarse en la forma siguiente:
HA + H₂O => H3O+ + A–
Donde HA representa el ácido que se ioniza, H3O+ al ion hidronio, y A– su base conjugada. Si la Ka es alta, una mayor parte de HA se disociará y habrá por consiguiente mayor concentración del ion hidronio.
Este incremento de acidez se puede determinar observando un cambio en el pH de la solución, cuyo valor está por debajo de 7.
Equilibrio de ionización
Las dobles flechas en la ecuación química superior indican que se establece un equilibrio entre reactantes y producto. Como todo equilibrio posee una constante, lo mismo ocurre con la ionización de un ácido y se expresa de la siguiente manera:
K = [H3O+][A–]/[HA][H₂O]
Termodinámicamente, se define la constante Ka en términos de actividades, no de concentraciones.
Sin embargo, en disoluciones acuosas diluidas, la actividad del agua es alrededor de 1, y las actividades del ion hidronio, de la base conjugada y del ácido no disociado son cercanas a sus concentraciones molares.
Por estas razones, se introdujo el uso de la constante de disociación (ka) que no incluye la concentración del agua.
Esto permite que la disociación de ácido débil pueda esquematizarse de una manera más sencilla, y la constante de disociación (Ka) se exprese en una misma forma.
HA => H+ + A–
Ka = [H+][A–] / [HA]
Ka
La constante de disociación (Ka) es una forma de expresión de una constante de equilibrio.
Las concentraciones del ácido no disociado, la base conjugada y del ion hidronio o hidrógeno permanecen constantes una vez que se alcanza la condición de equilibrio. Por otro lado, la concentración de la base conjugada y la del ion hidronio son exactamente iguales.
Sus valores vienen dados en potencias de 10 con exponentes negativos, por lo que se introdujo una forma de expresión de Ka más simple y manejable, a la que denominaron pKa.
pKa = – log Ka
Al pKa comúnmente se le denomina constante de disociación ácida. El valor del pKa es un indicio claro de la fuerza de un ácido.
Aquellos ácidos que tienen un valor del pKa menores o más negativos que -1,74 (pKa del ion hidronio) se consideran como ácidos fuertes. Mientras que los ácidos que tienen un pKa mayor a -1,74, se consideran como ácidos no fuertes.
Ecuación de Henderson-Hasselbalch
De la expresión de Ka se deduce una ecuación que resulta de inmensa utilidad en cálculos analíticos.
Ka = [H+][A–] / [HA]
Tomando logaritmos,
log Ka = log H+ + log A– – log HA
Y despejando log H+:
-log H = – log Ka + log A– – log HA
Usando entonces las definiciones de pH y pKa, y reagrupando términos:
pH = pKa + log (A– / HA)
Esta es la famosa ecuación de Henderson-Hasselbalch.
Uso
La ecuación de Henderson-Hasselbach se usa para estimar el pH de soluciones amortiguadoras, así para conocer cómo influencian en el pH las concentraciones relativas de la base conjugada y del ácido.
Cuando la concentración de la base conjugada es igual a la concentración del ácido, la relación entre las concentraciones de ambos términos es igual a 1, y, por lo tanto, su logaritmo es igual a 0.
Como consecuencia, el pH = pKa, teniendo esto mucha importancia, ya que en esta situación la eficiencia amortiguadora es máxima.
Se suele tomar la zona de pH donde existe la máxima capacidad amortiguadora, aquella donde el pH = pka ± 1 unidad de pH.
Ejercicios de constante de ionización
Ejercicio 1
La disolución diluida de un ácido débil, tiene en el equilibrio las concentraciones siguientes: ácido no disociado = 0,065 M y concentración de la base conjugada = 9·10-4 M. Calcule la Ka y pKa del ácido.
La concentración del hidrogenión o del ion hidronio es igual a la concentración de la base conjugada, ya que provienen de la ionización del mismo ácido.
Sustituyendo en la ecuación:
Ka = [H+][A–] / HA
Sustituyendo en la ecuación por sus valores respectivos:
Ka = (9·10-4 M)(9·10-4 M) / 65·10-3 M
= 1,246·10-5
Y calculando entonces su pKa
pKa = – log Ka
= – log 1,246·10-5
= 4,904
Ejercicio 2
Un ácido débil con una concentración 0,03 M, tiene una constante de disociación (Ka) = 1,5·10-4. Calcule: a) pH de la disolución acuosa; b) el grado de ionización del ácido.
En el equilibrio, la concentración del ácido es igual a (0,03 M – x), siendo x la cantidad del ácido que se disocia. Por lo tanto, la concentración de hidrógeno o del ion hidronio es x, al igual que la concentración de la base conjugada.
Ka = [H+][A–] / [HA] = 1,5·10-6
[H+] = [A–] = x
Y [HA] = 0,03 M – x. El valor pequeño de la Ka indica que el ácido se disoció probablemente muy poco, por lo que (0,03 M – x) es aproximadamente igual a 0,03 M.
Sustituyendo en Ka:
1,5·10-6 = x2 /3·10-2
x2 = 4,5·10-8 M2
x = 2,12 x 10-4 M
Y como x = [H+]
pH = – log [H+]
= – log [2,12 x 10-4]
pH = 3.67
Y finalmente, respecto al grado de ionización: se puede calcular mediante la expresión siguiente:
[H+] o [A–] / HA] x 100%
(2,12·10-4 / 3·10-2) x 100%
0,71%
Ejercicio 3
Calculo la Ka a partir del porcentaje de ionización de un ácido, sabiendo que se ioniza en un 4,8% a partir de una concentración inicial de 1,5·10-3 M.
Para calcular la cantidad el ácido que se ioniza se determina su 4,8%.
Cantidad ionizada = 1,5·10-3 M (4,8/100)
= 7,2 x 10-5 M
Esta cantidad del ácido ionizado es igual a la concentración de la base conjugada y a la concentración del ion hidronio o hidrogenión en el equilibrio.
La concentración del ácido en el equilibrio = concentración inicial del ácido – la cantidad del ácido ionizado.
[HA] = 1,5·10-3 M – 7,2·10-5 M
= 1,428 x 10-3 M
Y resolviendo entonces con las mismas ecuaciones
Ka = [H+][A–] / [HA]
Ka = (7,2·10-5 M x 7,2·10-5 M) / 1,428·10-3 M
= 3,63 x 10-6
pKa = – log Ka
= – log 3,63 x 10-6
= 5,44
Referencias
- Dissociation constant. Recuperado de chem.libretexts.org
- Dissociation constant. Recuperado de en.wikipedia.org
- Whitten, K. W., Davis, R. E., Peck, L. P. Y Stanley, G. G. (2008). Química. Cengage Learning.
- Segel I. H. (1975). Biochemical Calculations.
