Bicarbonato de calcio: qué es, estructura, propiedades, riesgos y usos

¿Qué es el bicarbonato de calcio?
El bicarbonato de calcio es una sal inorgánica con fórmula química Ca(HCO3)2. Se origina en la naturaleza a partir del carbonato de calcio presente en las piedras de caliza y en minerales como la calcita.
El bicarbonato de calcio es más soluble en el agua que el carbonato de calcio. Esta característica ha permitido la formación de los sistemas kársticos en las rocas calizas y en la estructuración de las cuevas.
Las aguas subterráneas que atraviesan las grietas se van saturando en su desplazamiento de dióxido de carbono (CO2).
Estas aguas erosionan las rocas calizas liberando el carbonato de calcio (CaCO3) que va a formar el bicarbonato de calcio, según la reacción siguiente:
CaCO3(s) + CO2(g) + H2O(l) => Ca(HCO3)2(aq)
Esta reacción ocurre en las cuevas donde se originan aguas muy duras. El bicarbonato de calcio no se encuentra en estado sólido sino en una solución acuosa, junto con el Ca2+, el bicarbonato (HCO3–) y el ión carbonato (CO32-).
Posteriormente, al disminuir la saturación del dióxido de carbono en el agua, se produce la reacción inversa, es decir, la transformación del bicarbonato de calcio en carbonato de calcio:
Ca(HCO3)2(aq) => CO2 (g) + H2O (l) + CaCO3 (s)
El carbonato de calcio es poco soluble en el agua, esto hace que se produzca su precipitación como un sólido. La reacción anterior tiene mucha importancia en la formación de las estalactitas, estalagmitas y otros espeleotemas en las cuevas.
Estas estructuras rocosas se van formando a partir de las gotas de agua que caen del techo de las cuevas. El CaCO3 presente en las gotas de agua se va cristalizando para formar las estructuras mencionadas.
El hecho de no encontrarse el bicarbonato de calcio en estado sólido ha dificultado su utilización, encontrándose pocos ejemplos al respecto.
Estructura del bicarbonato de calcio
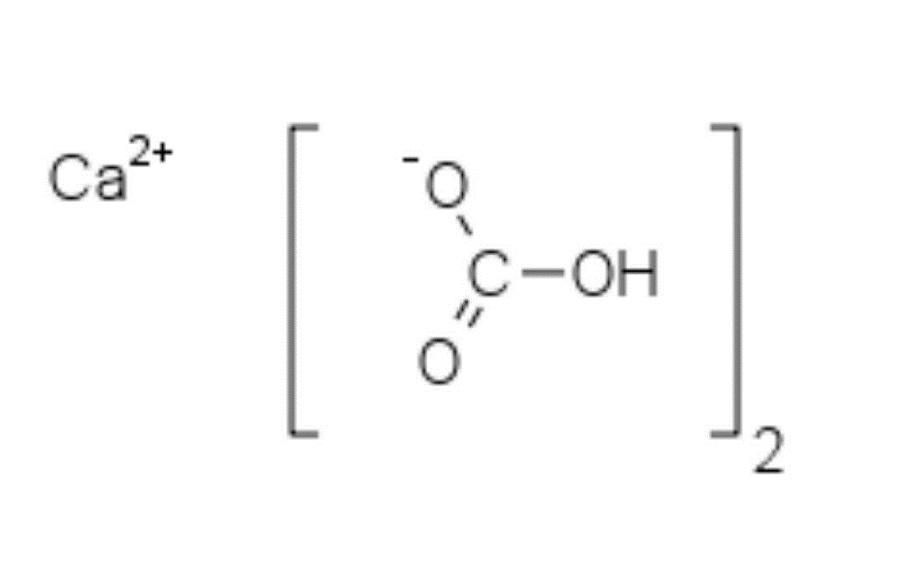
En la imagen superior se muestran dos aniones HCO3– y un catión Ca2+ interactuando electrostáticamente. El Ca2+, de acuerdo con la imagen, debería ubicarse en el medio, ya que así los HCO3– no se repelerían entre sí por sus cargas negativas.
La carga negativa en el HCO3– se deslocaliza entre dos átomos de oxígeno, mediante la resonancia entre el grupo carbonilo C=O y el enlace C–O–; mientras que en el CO32–, esta se deslocaliza entre los tres átomos de oxígeno, ya que el enlace C–OH se encuentra desprotonado y puede recibir una carga negativa por resonancia.
Las geometrías de estos iones pueden considerarse como esferas de calcio rodeadas de triángulos planos de carbonatos con un extremo hidrogenado. En términos de relación de tamaño, el calcio es notablemente más pequeño que los iones HCO3–.
Soluciones acuosas
El bicarbonato de calcio no puede formar sólidos cristalinos, y realmente consiste en soluciones acuosas de esta sal. En ellas, los iones no están solos, como en la imagen, sino rodeados de moléculas de H2O.
Cada ion se ve rodeado de una esfera de hidratación, la cual dependerá del metal, de la polaridad y la estructura de la especie disuelta.
El Ca2+ se coordina con los átomos de oxígeno del agua para formar así un acuocomplejo, Ca(OH2)n2+, donde n por lo general se considera que es seis; es decir, un “octaedro acuoso” en torno al calcio.
Mientras que los aniones HCO3– interaccionan bien, sea con puentes de hidrógeno (O2CO–H—OH2) o con los átomos de hidrógeno del agua en dirección a la carga negativa deslocalizada (HOCO2– H–OH, interacción dipolo-ion).
Estas interacciones entre el Ca2+, HCO3– y el agua son tan eficientes, que hacen que el bicarbonato de calcio sea muy soluble en ese solvente; a diferencia del carbonato de calcio (CaCO3), en el cual las atracciones electrostáticas entre el Ca2+ y el CO32– son muy fuertes, precipitando de la solución acuosa.
Además del agua, hay moléculas de CO2 alrededor, las cuales reaccionan lentamente para aportar más HCO3– (dependiendo de los valores de pH).
Sólido hipotético
Hasta aquí, los tamaños y cargas de los iones en el bicarbonato de calcio, ni la presencia del agua, explican por qué no existe el compuesto sólido; es decir, cristales puros que puedan ser caracterizados por cristalografía de rayos X. El bicarbonato de calcio no es más que unos iones presentes en el agua del cual continúan creciendo las formaciones cavernosas.
Si Ca2+ y el HCO3– pudieran aislarse del agua evitando la siguiente reacción química:
Ca(HCO3)2(aq) → CaCO3(s) + CO2(g) + H2O(l)
Entonces estos podrían agruparse en un sólido cristalino blanco con proporciones estequiométricas 2:1 (2HCO3/1Ca).
No hay estudios acerca de su estructura, pero podría comparársele con la del bicarbonato de sodio (pues el bicarbonato de magnesio, Mg(HCO3)2, tampoco existe como sólido), o con la del carbonato de calcio.
Estabilidad: bicarbonato de sodio (NaHCO3) vs. bicarbonato de calcio (Ca(HCO3)2)
El bicarbonato de sodio cristaliza en el sistema monoclínico, y el bicarbonato de calcio en los sistemas trigonal (calcita) y ortorrómbico (aragonita).
Si se sustituyera el Na+ por el Ca2+, la red cristalina se desestabilizaría por la mayor diferencia de tamaños; es decir, el Na+ por ser más pequeño, forma un cristal más estable con el HCO3– en comparación al del Ca2+.
De hecho, el Ca(HCO3)2(aq) necesita que el agua se evapore para que así puedan agruparse sus iones en un cristal; pero la red cristalina de este no es lo suficiente fuerte para hacerlo a temperatura ambiente. Al calentar el agua, ocurre la reacción de descomposición (ecuación de arriba).
Estando el ion Na+ en solución, este formaría el cristal con el HCO3– antes de su descomposición térmica.
La razón entonces de por qué el bicarbonato de calcio no cristaliza (teóricamente), es por la diferencia de los radios iónicos o tamaños de sus iones, los cuales no pueden forman un cristal estable antes de su descomposición.
Bicarbonato de calcio (Ca(HCO3)2) vs. carbonato de calcio (CaCO3)
Si por otro lado, se adicionara H+ a las estructuras cristalinas del carbonato de calcio, cambiarían drásticamente sus propiedades físicas. Quizás, sus puntos de fusión bajen notablemente, e incluso, las morfologías de los cristales terminen modificadas.
Propiedades físicas y químicas
Formula química
Ca(HCO3)2
Peso molecular
162,11 g/mol
Estado físico
No se presenta en estado sólido. Se encuentra en solución acuosa, y cuando se le aplica calor para que evapore, se convierte en carbonato de calcio.
Solubilidad en agua
16,1 g/100 ml a 0º C; 16,6 g/100 ml a 20º C y 18,4 g/100 ml a 100º C.
Estos valores son indicativos de una gran afinidad de las moléculas de agua por los iones del bicarbonato de calcio, tal como se explicó en el apartado anterior. Mientras, apenas 15 mg de carbonato de calcio se disuelven en un litro de agua, lo cual refleja sus fuertes interacciones electrostáticas.
Debido a que el bicarbonato de calcio no puede formar un sólido, no puede determinarse experimentalmente su solubilidad.
Sin embargo, dadas las condiciones creadas por el CO2 disuelto en el agua que rodea a la piedra caliza, pudiera calcularse la masa de calcio disuelta a una temperatura T; masa que sería igual a la concentración del bicarbonato de calcio.
A distintas temperaturas, la masa disuelta aumenta tal como muestran los valores a 0, 20 y 100º C. Entonces, de acuerdo a estos experimentos, se determina cuánto del bicarbonato de calcio se disuelve en las cercanías del carbonato de calcio, en un medio acuoso gasificado con CO2.
Una vez escape el CO2 gaseoso, el carbonato de calcio precipitará, pero no el bicarbonato de calcio.
Puntos de fusión y de ebullición
La red cristalina del Ca(HCO3)2 es mucho más débil que la del CaCO3. De poderse obtener en estado sólido, y medir la temperatura a la que funde dentro de un fusiómetro, seguramente se obtendría un valor muy por debajo de los 899º C. Igualmente, cabría esperarse lo mismo en la determinación del punto de ebullición.
Punto de combustión
No es combustible.
Riesgos
Dado que este compuesto no existe en forma sólida, es poco probable que represente un riesgo el manipular sus soluciones acuosas, ya que tanto los iones Ca2+ como HCO3– no son nocivos a bajas concentraciones; y por lo tanto, el mayor riesgo, que sería ingerir dichas soluciones, pudiera deberse solamente a una dosis peligrosa de calcio ingerida.
Si el compuesto formara un sólido, aun siendo quizás físicamente diferente al CaCO3, sus efectos tóxicos pudieran no ir más allá de simples molestias y resecamientos luego del contacto físico o por inhalación.
Usos
– Las soluciones de bicarbonato de calcio se han utilizado desde hace mucho tiempo para lavar los papeles antiguos, especialmente obras de arte o documentos históricamente importantes.
– Se han usado las soluciones de bicarbonato en la prevención de la osteoporosis. Sin embargo, se ha observado, en un caso, efectos secundarios como hipercalcemia, alcalosis metabólica y falla renal.
– El bicarbonato de calcio se administra, ocasionalmente, por vía intravenosa para corregir el efecto depresivo de una hipokalemia en el funcionamiento cardíaco.
– Se utiliza para calmar la acidez estomacal.
Referencias
- Wikipedia (2018). Calcium bicarbonate. Tomado de: en.wikipedia.org
- Sirah Dubois (03 de octubre de 2017). What Is Calcium Bicarbonate? Recuperado de: livestrong.com
- Science Learning Hub (2018). Carbonate chemistry. Recuperado de: sciencelearn.org.nz
- PubChem (2018). Calcium Bicarbonate. Recuperado de: pubchem.ncbi.nlm.nih.gov
