¿Qué son el ánodo y el cátodo?
El ánodo y el cátodo son los tipos de electrodos que se encuentran en las celdas electroquímicas. Estos son dispositivos capaces de producir energía eléctrica a través de una reacción química. Las celdas electroquímicas más usadas son las pilas.
Existen dos tipos de celdas electroquímicas, las celdas electrolíticas y las células galvánicas o voltaicas. En las celdas electrolíticas, la reacción química que produce la energía no sucede de forma espontánea, sino que la corriente eléctrica se transforma en una reacción química de oxidación-reducción.
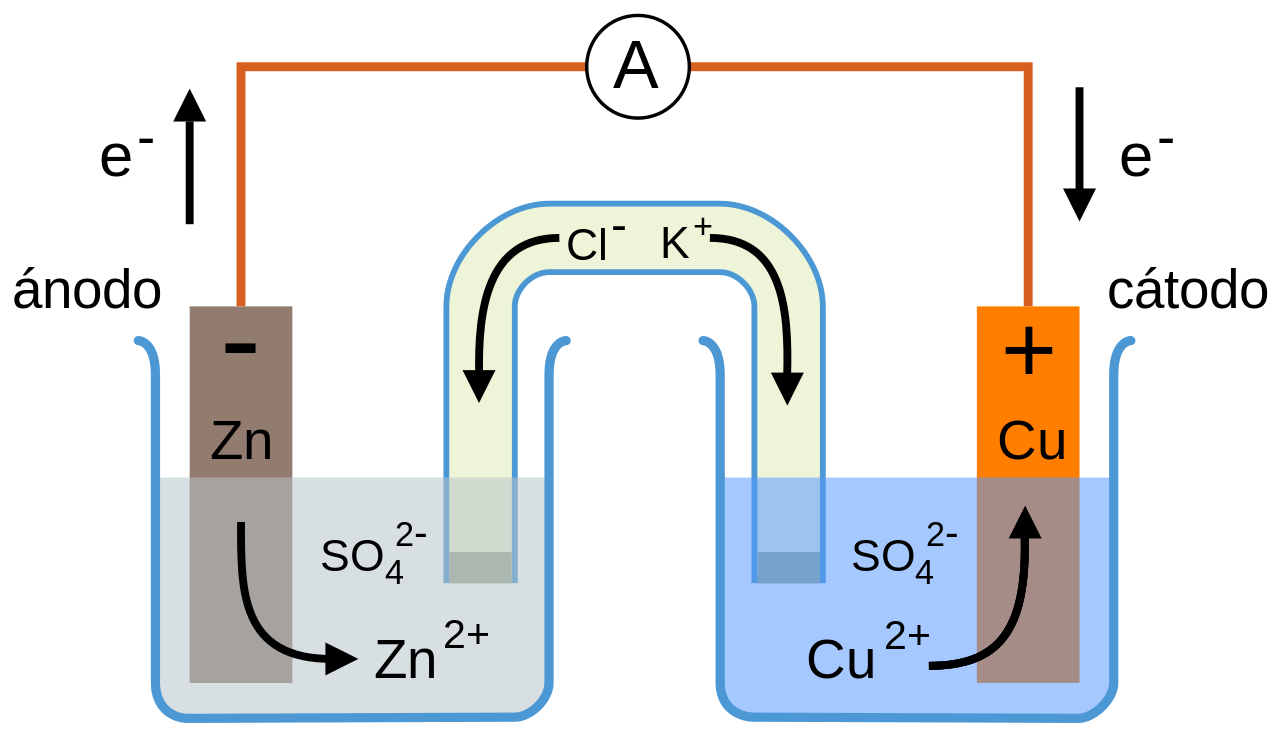
La celda galvánica está compuesta por dos semiceldas. Estas están conectadas por dos elementos, un conductor metálico y un puente salino.
El conductor eléctrico, como indica su nombre, conduce la electricidad porque tiene muy poca resistencia al movimiento de la carga eléctrica. Los mejores conductores suelen ser metales.
El puente salino es un tubo que conecta las dos semiceldas, mientras mantiene el contacto eléctrico de las mismas, y sin dejar que los componentes de cada celda se unan.Cada semicelda de la celda galvánica contiene un electrodo y un electrolito.
Cuando se produce la reacción química, una de las semiceldas pierde electrones hacia su electrodo, a través del proceso de oxidación; mientras que la otra gana los electrones para su electrodo, a través del proceso de reducción.
Los procesos de oxidación se producen en el ánodo, y los procesos de reducción en el cátodo
Índice del artículo
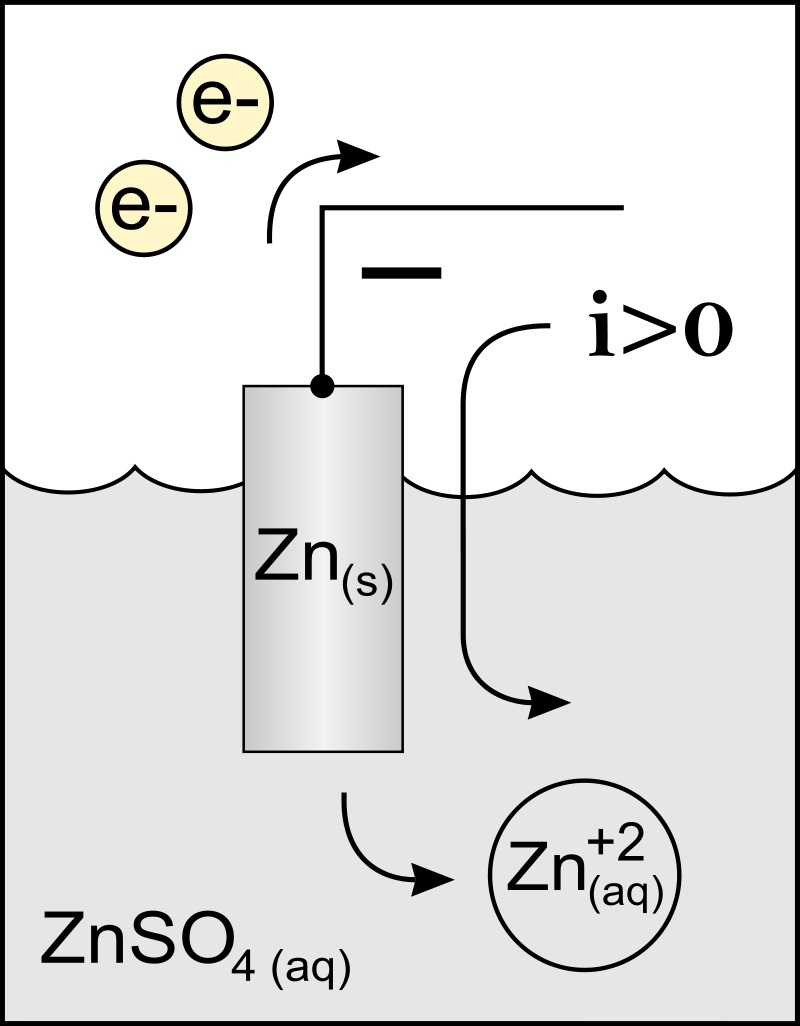
El nombre del ánodo proviene del griego ανά (aná): hacia arriba, y οδός (odós): camino. Faraday fue el que acuñó este término en el siglo XIX.
La mejor definición de ánodo es el electrodo que pierde electrones en una reacción de oxidación. Normalmente se vincula al polo positivo del tránsito de la corriente eléctrica, pero no siempre es así.
Pese que en las pilas el ánodo es el polo positivo, en las luces led es todo lo contrario, siendo el ánodo el polo negativo.
Normalmente se define el sentido de la corriente eléctrica, apreciándolo como un sentido de las cargas libres, pero si el conductor no es metálico, las cargas positivas que se producen se trasladan al conductor externo.
Este movimiento implica que tenemos cargas positivas y negativas que se mueven en sentidos opuestos, por lo que se dice que el sentido de la corriente es el recorrido de las cargas positivas de los cationes que se encuentran en el ánodo hacia la carga negativa de los ánodos que se encuentran en el cátodo.
En las celdas galvánicas, al tener un conductor metálico, la corriente generada en la reacción sí que sigue el camino desde el polo positivo al negativo.
Pero en las células electrolíticas, al no tener un conductor metálico, sino un electrolito, pueden encontrarse iones con carga positiva y negativa que se mueven en sentidos opuestos.
Los ánodos termoiónicos reciben la mayor parte de los electrones que provienen del cátodo, calientan el ánodo y tienen que encontrar una forma de disiparse. Este calor se genera en la tensión que se produce entre los electrones.
Existe un tipo de ánodos especiales, como los que se encuentran dentro de los rayos X. En estos tubos, la energía que producen los electrones, además de producir los rayos X, genera una gran energía que calienta el ánodo.
Este calor se produce a la diferente tensión que hay entre ambos electrodos y que ejerce presión en los electrones. Cuando los electrones se mueven en la corriente eléctrica, estos impactan contra el ánodo transmitiéndole su calor.
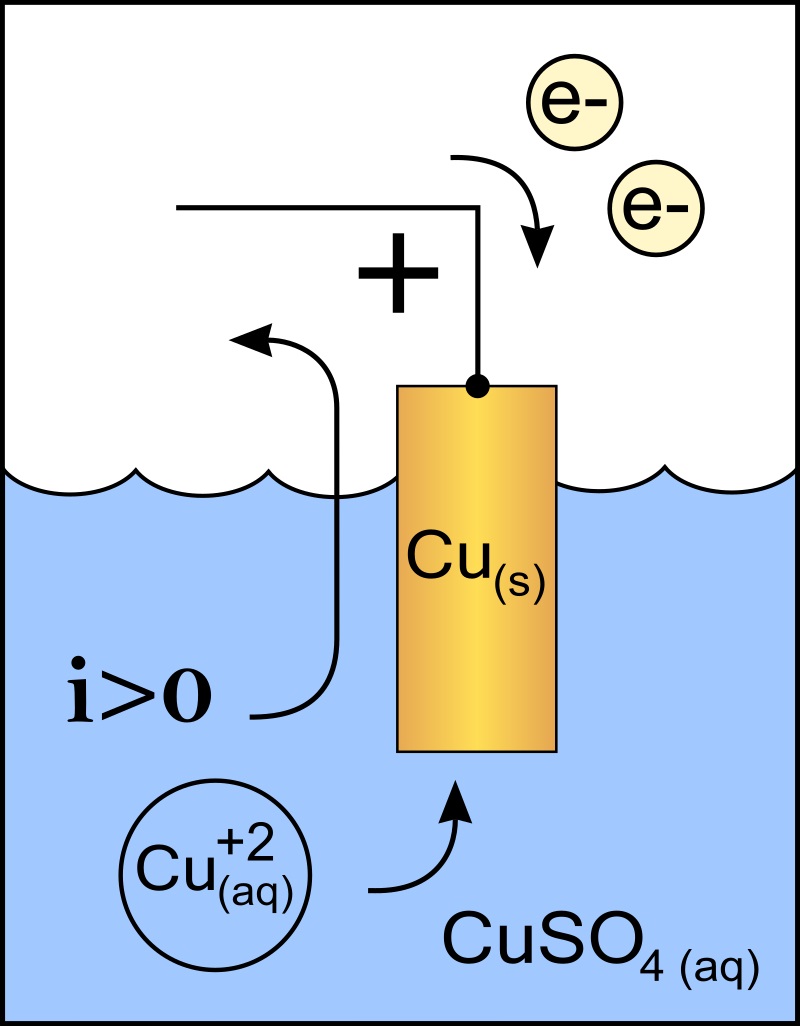
El cátodo es el electrodo con carga negativa, que en la reacción química sufre una reacción de reducción, donde su estado de oxidación se reduce cuando recibe electrones.
Al igual que con el ánodo, fue Faraday quién sugirió el término cátodo que proviene del griego κατά [catá]: ‘hacia abajo’, y ὁδός [odós]: ‘camino’. A este electrodo, se le atribuyó la carga negativa a lo largo del tiempo.
Este planteamiento resultó falso, ya que dependiendo del dispositivo en el que se encuentre, tiene una carga u otra.
Esta relación con el polo negativo, al igual que con el ánodo, surge por la suposición que la corriente fluye desde el polo positivo hasta el negativo. Esto surge dentro de una celda galvánica.
Dentro de las celdas electrolíticas, el medio de traspaso de la energía, al no ser en un metal sino en un electrolito, pueden coexistir iones negativos y positivos que se mueven en sentidos opuestos. Pero por convenio, se dice que la corriente va desde el ánodo hacia el cátodo.
Cátodos especiales
Un tipo de cátodos específicos son los cátodos termoiónicos. En estos, el cátodo emite electrones por el efecto del calor.
En las válvulas termoiónicas, el cátodo puede calentarse a sí mismo haciendo circular una corriente de caldeo en un filamento que tiene acoplado a él.
Si tomamos una celda galvánica, que es la celda electroquímica más común, podemos formular la reacción de equilibrio que se genera.
Cada semicelda que conforma la celda galvánica, tiene una tensión característica conocida como potencial de reducción. Dentro de cada semicelda se produce una reacción de oxidación entre los distintos iones.
Cuando esta reacción llega a un equilibro, la célula no puede proporcionar más tensión. En este momento, la oxidación que esté teniendo lugar en la semicelda de ese momento tendrá un valor positivo cuanto más cerca se encuentre del equilibrio. El potencial de la reacción será mayor cuanto más equilibrio se alcance.
Cuando el ánodo está en equilibrio, comienza a perder electrones que pasan a través del conductor hacia el cátodo.
En el cátodo se está produciendo la reacción de reducción, cuanto más lejos se encuentre del equilibrio más potencial tendrá la reacción al producirse y tomar los electrones que provienen del ánodo.
- HUHEEY, James E., et al.Inorganic chemistry: principles of structure and reactivity. Pearson Education India, 2006.
- SIENKO, Michell J.; ROBERT, A.Chemistry: principles and properties. New York, US: McGraw-Hill, 1966.
- BRADY, James E.General chemistry: principles and structure. Wiley, 1990.
- PETRUCCI, Ralph H., et al.Química general. Fondo Educativo Interamericano, 1977.
- MASTERTON, William L.; HURLEY, Cecile N.Chemistry: principles and reactions. Cengage Learning, 2015.
- CHARLOT, Gaston; TRÉMILLON, Bernard; BADOZ-LAMBLING, J. Las reacciones electroquímicas. Toray-Masson, 1969.
