Sólidos amorfos: estructura, propiedades, ejemplos
Los sólidos amorfos son aquellos que no poseen una estructura ordenada de largo alcance. Son lo opuesto a lo que se conoce por un sólido cristalino. Sus partículas se asocian de un modo desordenado, parecido al de los líquidos, pero con la fuerza suficiente para que cohesionen en una estructura sólida.
Este carácter amorfo es más común de lo que se pudiera pensar; es de hecho, uno de los estados posibles que puede adoptar la materia condensada. Con esto se entiende que cualquier compuesto capaz de solidificar y, por ende, cristalizar, puede asimismo aglomerarse de manera desordenada si las condiciones experimentales lo permiten.

Lo anterior dicho aplica usualmente para las sustancias puras, sean elementos o compuestos. Pero también es válido en el caso de las mezclas. Muchas mezclas sólidas resultan amorfas, tal como sucede con el algodón de azúcar, el chocolate, la mayonesa o el puré de patatas.
El que un sólido sea amorfo no lo vuelve menos valioso que uno cristalino. El desorden estructural en ocasiones lo dota de propiedades únicas que no exhibiría en una condición cristalina. Por ejemplo, en la industria fotovoltaica se prefiere el silicio amorfo antes que el cristalino para ciertas aplicaciones de pequeña escala.
Índice del artículo
- 1 Estructura de los sólidos amorfos
- 2 Propiedades
- 3 Preparación
- 4 Ejemplos de sólidos amorfos
- 5 Referencias
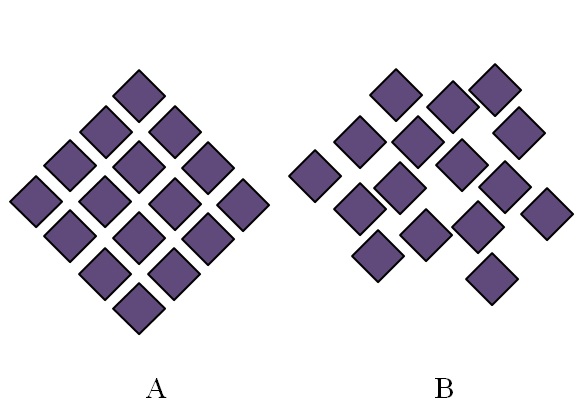
La estructura de un sólido amorfo es desordenada; carece de periodicidad o de un patrón estructural. La imagen superior ilustra este punto. A corresponde a un sólido cristalino, mientras B representa un sólido amorfo. Nótese que en B los rombos morados se disponen arbitrariamente, aun cuando tanto en A como en B existan el mismo tipo de interacciones.
Si se observa además a B, se verá que hay espacios que parecieran estar vacíos; es decir, la estructura presenta defectos o irregularidades. Por lo tanto, parte del desorden microscópico o interno de un sólido amorfo se debe a que sus partículas se “acomodan” de tal modo que la estructura resultante tiene muchas imperfecciones.
Al principio se hizo mención del alcance en el grado de ordenamiento de los sólidos amorfos. En B apenas hay un par de rombos que parecen alineados ordenadamente. Puede haber regiones ordenadas; pero solo a corto alcance.
Se dice entonces que un sólido amorfo está hecho de inconmensurables cristales diminutos de distintas estructuras. La sumatoria de todas estas estructuras termina volviéndose laberíntica y sin sentido: la estructura global se torna amorfa, compuesta por un sinfín de bloques cristalinos desparramados por doquier.
Las propiedades de un sólido amorfo varían en función de la naturaleza de sus partículas conformantes. Sin embargo, hay ciertas características generales que pueden mencionarse. Los sólidos amorfos pueden ser vítreos, cuando presentan aspectos similares a los cristales; o gelatinosos, resinosos, o polvorientos.
Al ser sus estructuras desordenadas no generan espectros confiables de difracción de rayos X. Asimismo, sus puntos de fusión no son precisos, sino que abarcan un intervalo de valores.
Por ejemplo, el punto de fusión para un sólido amorfo puede variar de 20 a 60 ºC. Mientras, los sólidos cristalinos funden a una temperatura específica, o en un intervalo estrecho si contienen muchas impurezas.
Otra característica de los sólidos amorfos es que cuando se quiebran o fracturan, no originan fragmentos geométricos y de caras planas, sino fragmentos irregulares y con caras curvadas. Cuando no son vítreos, se presentan como cuerpos polvorientos y opacos.
Más que un sólido amorfo, conviene tratar este concepto como un ‘estado amorfo’. Todos los compuestos (iónicos, moleculares, poliméricos, metálicos, etc.) son capaces, hasta cierto punto, y si las condiciones experimentales lo permiten, de formar sólidos amorfos y no cristalinos.
Por ejemplo, en las síntesis orgánicas los compuestos sólidos al principio se obtienen como masas polvorientas. Es tan alto su contenido de impurezas, que estas afectan su orden molecular a largo alcance. Es por eso que cuando el producto se recristaliza una y otra vez, el sólido se van tornando cada vez más cristalino; va perdiendo su carácter amorfo.
Esto no quiere decir sin embargo que los sólidos amorfos sean necesariamente materiales impuros; varios de ellos son amorfos por su propia naturaleza química.
Una sustancia pura puede solidificar amorfamente si su líquido se enfría bruscamente, de tal modo que sus partículas no cristalicen, sino que adopten una configuración vítrea. Es tan rápido el enfriamiento, que las partículas no tienen tiempo suficiente para acomodar los bloques cristalinos que apenas logran “nacer”.
El agua, por ejemplo, es capaz de existir en un estado vítreo, amorfo, y no solo como hielo.

Prácticamente cualquier material cristalino puede ajustarse a una forma amorfa (y viceversa). Esto sucede con algunos minerales, que por razones geoquímicas no pudieron establecer formalmente sus cristales convencionales. Otros, en cambio, no forman cristales sino vidrios; tal es el caso de la obsidiana.
Por otro lado, los polímeros tienden a solidificar amorfamente, ya que sus moléculas son demasiado grandes para definir una estructura ordenada. Aquí entran las resinas, los cauchos, la espuma de poliestireno (anime), los plásticos, el teflón, la baquelita, entre otros.
Los sólidos biológicos son en su gran mayoría amorfos, como por ejemplo: el tejido de los órganos, la piel, los cabellos, la córnea, etc. Asimismo, la grasa y las proteínas forman masas amorfas; que sin embargo, con una preparación adecuada, pueden cristalizar (cristales de ADN, proteínas, grasas).
Aunque se haya dejado casi de último, el sólido amorfo más representativo es, por lejos, el vidrio en sí mismo. Su composición en esencia es la misma que la del cuarzo: SiO2. Tanto el cristal de cuarzo como el vidrio son redes covalentes tridimensionales; solamente que la red del vidrio es desordenada, con enlaces Si-O de distintas longitudes.

El vidrio es el sólido amorfo por excelencia, y los materiales que adquieren una apariencia parecida se dice que tienen un estado vítreo.
Tenemos al carbono amorfo, siendo el carbono activado uno de los más importantes por sus capacidades absorbentes. Asimismo, está el silicio y germanio amorfos, con aplicaciones electrónicas donde actúan como semiconductores.
Y finalmente, existen aleaciones amorfas, que por la disparidad de sus átomos metálicos conformantes no establecen una estructura cristalina.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Rachel Bernstein & Anthony Carpi. (2020). Properties of Solids. Recuperado de: visionlearning.com
- Wikipedia. (2020). Amorphous solid. Recuperado de: en.wikipedia.org
- Richard Zallen, Ronald Walter Douglas and Others. (31 de julio de 2019). Amorphous solid. Encyclopædia Britannica. Recuperado de: britannica.com
- Elsevier B.V. (2020). Amorphous Solid. ScienceDirect. Recuperado de: sciencedirect.com
- Danielle Reid. (2020). Amorphous Solid: Definition & Examples. Study. Recuperado de: study.com
- Rubik’s cube artwork. (2008). What is an amorphous material? Recuperado de: web.physics.ucsb.edu
