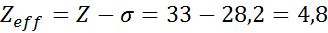Carga nuclear efectiva: qué es, características, fórmula, ejemplo
¿Qué es la carga nuclear efectiva?
La carga nuclear efectiva (representada como Zeff y en algunos casos como Z*) es la carga nuclear neta que experimenta un electrón cuando este se encuentra en un átomo polielectrónico (es decir, que tiene más de un electrón).
De forma más precisa, es la carga eléctrica que tendría el núcleo de un átomo hipotético capaz de atraer a su único electrón con la misma fuerza con la que el núcleo del átomo real atrae a ese mismo electrón en presencia de todos los demás electrones.
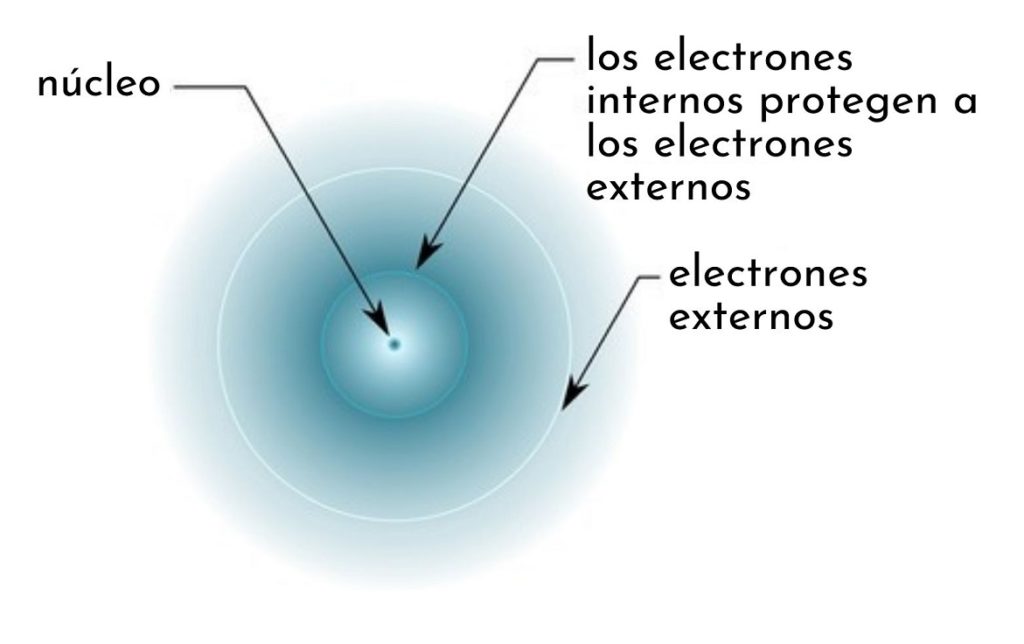
Se trata de una carga nuclear corregida que toma en cuenta el efecto de la presencia de otros electrones en un átomo polielectrónico. Esta carga reducida explica por qué los electrones más externos en un átomo polielectrónico están más débilmente unidos al núcleo que los electrones internos.
La carga nuclear efectiva es un concepto de gran importancia en la química, ya que permite comprender la tendencia periódica de muchas propiedades tales como el radio atómico, el radio iónico, la electronegatividad, las energías de ionización y más.
¿Por qué existe la carga nuclear efectiva?
La carga nuclear efectiva surge de dos fenómenos:
- El efecto de apantallamiento de los electrones en los átomos polielectrónicos.
- La repulsión electrostática entre los electrones debida a que todos tienen la misma carga eléctrica.
El efecto apantallante consiste en una especie de escudo formado por los electrones internos de un átomo que tapa al núcleo. Esto hace que los electrones más externos “sientan” una menor atracción por parte del núcleo que la que sentirían si los demás electrones no estuvieran presentes.
Por ejemplo, la carga nuclear del átomo de sodio es +11 (su número atómico es Z=11), pero, el único electrón de valencia que posee, en realidad siente la fuerza de atracción de una carga de tan solo +2,2.
En otras palabras, el apantallamiento de los otros 10 electrones internos hace que el electrón de valencia del sodio sienta una fuerza de atracción nuclear de apenas la quinta parte de lo que debería ser.
Además del efecto de apantallamiento, la repulsión entre los electrones (los cuales tienen la misma carga eléctrica) también contribuye a contrarrestar la capacidad del núcleo para atraer a los electrones externos. Es decir, esta repulsión también contribuye a reducir la carga nuclear efectiva.
Características importantes de la carga nuclear efectiva
Cabe resaltar que el efecto apantallante responsable de reducir la carga nuclear efectiva solo afecta a los electrones que se encuentran en el mismo nivel de energía o en las capas superiores, pero no a los electrones más internos. Además, el efecto no es el mismo para los electrones que se encuentran en orbitales atómicos s y p que los que se encuentra en orbitales d y f.
Por esta razón, cada conjunto de electrones de cada capa o nivel de energía siente una carga nuclear efectiva diferente. Esto tiene implicaciones importantes en cuanto a las propiedades químicas de los diferentes elementos.
Tendencia periódica de la carga nuclear efectiva
A lo largo de un período
Los electrones ubicados en el mismo nivel de energía son menos apantallantes que los que se encuentran en niveles de energía inferiores.
Debido a esto, el efecto de apantallamiento no aumenta considerablemente a medida que nos movemos a lo largo de un período, pero la carga nuclear real sí. Por esta razón, la carga nuclear efectiva aumenta de izquierda a derecha en la tabla periódica.
A lo largo de un grupo
Por otro lado, al pasar de un período a otro en un mismo grupo (es decir, al movernos hacia abajo a lo largo de un grupo) se van añadiendo capas enteras de electrones internos muy apantallantes. Esto hace que la carga nuclear efectiva disminuya de arriba hacia abajo o, lo que es lo mismo, aumente de abajo hacia arriba.
Fórmula de la carga nuclear efectiva
La carga nuclear efectiva se puede calcular por medio de una ecuación semiempírica muy sencilla que toma en cuenta el valor real de la carga nuclear (dado por el número atómico, Z) y un término denominado constante de apantallamiento. Este último engloba en uno solo los efectos de la presencia de los demás electrones.
La ecuación viene dada por:
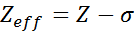
donde Z es el número atómico y σ (letra griega sigma) representa la constante de apantallamiento, la cual depende de la configuración electrónica.
Las reglas de Slater
La constante de apantallamiento se puede estimar a partir de un sistema conocido como las reglas de Slater. Estas reglas permiten calcular la constante de apantallamiento de un electrón al sumar las contribuciones de los demás electrones a dicha constante de apantallamiento. Estas reglas se pueden resumir así:
- Todo electrón que se encuentre en el mismo nivel de energía (nivel n0) aporta una cantidad de 0,35 a la constante de apantallamiento, a menos que ambos se encuentren en el nivel 1, en cuyo caso aporta 0,30.
- Cada electrón que se encuentre en el nivel inmediatamente anterior (en el nivel n0-1) en un orbital s o p, aporta 0,85; en cambio, si está en un orbital d o f aporta 1.
- Todos los demás electrones que se encuentren en niveles de energía inferiores (n0-2, n0-3, etc.), aportan 1 a la constante de apantallamiento.
Ejemplo de cálculo de carga nuclear efectiva
Electrón de valencia del átomo de sodio
La configuración electrónica del átomo de sodio es 1s22s22p63s1. Es decir que si queremos calcular la carga nuclear efectiva que siente el electrón de valencia (el electrón 3s1), debemos sumar las contribuciones de los otros 10 electrones siguiendo las reglas de Slater.
Como estamos calculando la constante de apantallamiento del electrón 3s1 (n0=3) y este está solo en la capa de valencia, no hay otros electrones en su mismo nivel de energía.
El nivel inmediatamente anterior es n0-1=2, donde hay 8 electrones en orbitales s o p que contribuyen 0,85 cada uno, y no hay electrones en orbitales d o f.
Finalmente, el único nivel más bajo que 2 es n=1, en el que solo hay 2 electrones. Todo esto se resume en la siguiente tabla:

Como se puede ver, lo 10 electrones internos del sodio aportan una constante de apantallamiento de 8,8, por lo que la carga nuclear efectiva que siente el electrón 3s1 es:
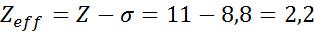
Electrones de valencia del arsénico
La configuración electrónica del arsénico es 1s22s22p63s23p63d104s24p3. La capa de valencia es la capa 4 (n0=4) que posee 5 electrones: (4s24p3). En este caso, cada uno de estos 5 electrones sentirá el efecto de los otros 4 que están en su misma capa y el de los otros 28 electrones internos como se muestra en la tabla:
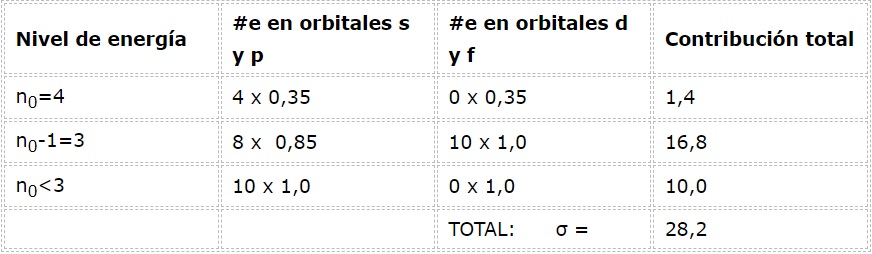
Por lo tanto, la carga nuclear efectiva que sienten los electrones de valencia del arsénico es: