Ácido fenoxiacético: síntesis, procedimiento, usos, riesgos
El ácido fenoxiacético es una sustancia de naturaleza orgánica, formada por la reacción entre el fenol y el ácido monocloroacético en presencia de una solución de hidróxido de sodio. El procedimiento utilizado para la obtención de este producto se denomina síntesis de éteres de Williamson.
El ácido fenoxiacético sintetizado es un precipitado de color blanco o incoloro, formado por cristales en forma de aguja, prácticamente insoluble en agua (solubilidad en agua 12 g/l-1), pero soluble en ácido acético, fenol y éter dietílico.
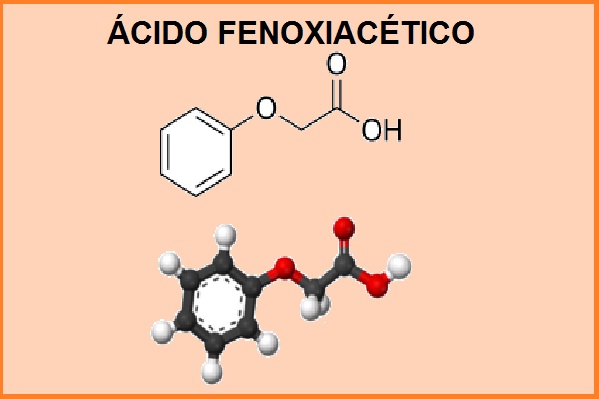
Su nombre químico es 2-fenoxietanoico y su fórmula molecular es C8 H8 O3. La masa molecular es de 152,15 g.mol-1. Este producto se comporta como un ácido débil y presenta un punto de fusión entre 98 a 100 °C y un punto de ebullición de 285 °C.
El ácido fenoxiacético es un producto intermedio en la síntesis de sustancias con propiedades herbicidas. Por sí solo, el ácido fenoxiacético tiene propiedades antifúngicas frente a Candida albicans y Trichophyton rubrum. También es útil como exfoliativo de la piel, eliminando el exceso de queratina en callosidades.
Es necesario tener precauciones para su manipulación pues al calentarse emite gases tóxicos que son corrosivos. Entre los gases se encuentra el cloruro de hidrógeno.
La exposición directa con este producto podría causar irritación leve de la piel o mucosas, aunque no de gran importancia a excepción de la afectación de la mucosa ocular sí puede ser grave. También produce irritación de las vías respiratorias si es inhalado y de la vía gástrica si es ingerido.
Es una sustancia no inflamable y bastante estable a temperatura ambiente, sin embargo, a temperaturas o presiones altas podría perder su estabilidad, y frente al agua puede liberar cierta cantidad de energía pero no lo hará violentamente.
Índice del artículo
El fenol es un alcohol y como tal se comporta como un ácido débil, es por ello que fácilmente pierde el protón ácido (H+) frente a un álcali (hidróxido de sodio) para convertirse en un alcóxido (fenolato). Este posteriormente, a través de una sustitución nucleofílica bimolecular, formará éter.
El alcóxido funciona como un nucleófilo, es decir, es capaz de ceder 2 electrones que se encuentran libres a otra sustancia. En el caso de la reacción que nos ocupa es el halogenuro de alquilo (ácido monocloroacético), de tal manera que se une fuertemente a través de enlaces covalentes con ella, formando una nueva sustancia que en este caso es el éter.
Durante la reacción ocurre un desplazamiento del ión halogenuro, el cual es sustituido por el anión alcóxido. A esta reacción se le conoce con el nombre de síntesis de éteres de Williamson.
La cantidad de producto obtenido y la rapidez con la que se produce dependerá de la concentración de los reactantes involucrados, ya que esta es una reacción cinética de segundo orden, donde la colisión de las moléculas (nucleófilo + halogenuro de alquilo) determina su efectividad.
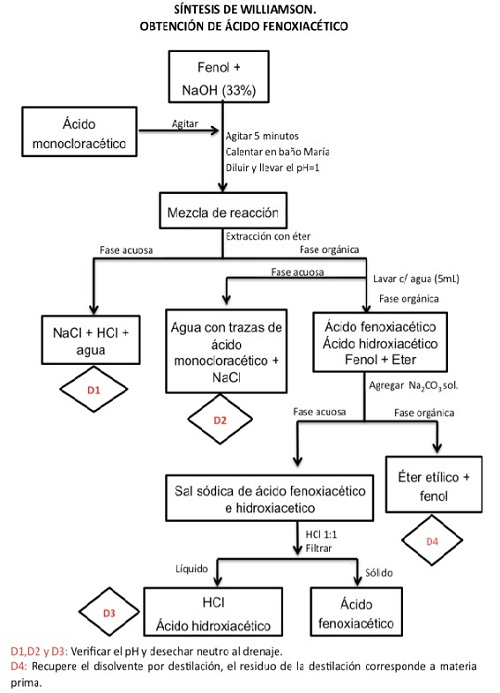
Para iniciar la síntesis del ácido fenoxiacético se pesa con mucho cuidado 0,5 gr de fenol y se coloca en un matraz con forma de pera y de boca única, con una capacidad para 50 ml. Se adiciona 2,5 ml de hidróxido de sodio (NaOH) al 33% (p/v) para disolverlo.
Compruebe la alcalinidad de la solución con un papel indicador de pH. Coloque una tapa de corcho al matraz y por 5 minutos mezcle fuertemente. Para la mezcla se puede utilizar un agitador magnético.
Posteriormente, adicione 0,75 g de ácido monocloroacético y repita el procedimiento de mezclado por 5 minutos.
En caso de que la mezcla busque endurecerse o volverse pastosa se puede añadir agua (entre 1 a 3 ml), pero esta se va adicionando poco a poco hasta que vuelva a la contextura anterior, sin diluir demasiado.
Destape el matraz y colóquelo en el interior de un baño de María que posea un sistema de reflujo durante 10 minutos. Si no se dispone del sistema de flujo se deja por 40 minutos.
Deje enfriar la solución y adicione 5 ml de agua, luego acidifique con una solución de HCl concentrado hasta llegar a pH 1. (Medir pH con un papel para tal fin).
Pase la mezcla con cuidado por el embudo de separación y extraiga en tres oportunidades, utilizando 5 ml de éter etílico en cada procedimiento.
Una los extractos orgánicos y vuelva a colocar en el embudo de separación para ejecutar un lavado con agua por triplicado, usando 5 ml de agua en cada lavado.
Las fracciones acuosas se separan para ser desechadas.
Posteriormente, la fracción orgánica se extrae con 3 ml de carbonato de sodio (Na2CO3) al 15% en tres oportunidades.
El extracto acuoso alcalino obtenido se coloca en baño de hielo y se acidifica con HCl hasta pH=1, lo que genera la precipitación del producto. El paso de acidificación debe realizarse con mucho cuidado adicionando gota a gota, debido a que la reacción genera espuma y si es agregado de forma brusca podría salpicar.
El sólido se obtiene por filtración al vacío, el precipitado se lava y se deja secar.
Se pesa el producto obtenido y se ve el rendimiento y el punto de fusión.
El ácido fenoxiacético por sí solo tiene una actividad fungicida frente a ciertos hongos, tales como Candida albicans y Trichophyton rubrum. Esta acción fue descrita en una investigación realizada por González y colaboradores.
El trabajo reveló que la concentración mínima inhibitoria o fungistática (CMI) y la concentración mínima fungicida (CMF) fue la misma (2,5 mg/ml) para 13 especies de Candida albicans provenientes de muestras clínicas, específicamente de pacientes que padecían de onicomicosis.
Mientras que una cepa de Candida albicans ATCC 10231 presentó una CMI de 2,5 mg/ml y una CMF de 5,0 mg/ml. Por su parte, Trichophyton rubrum presentó una CMI de 0.313 mg/ml y una CMF de 1.25 mg/ml en 8 cepas analizadas provenientes de uñas infectadas.
Además, el ácido fenoxiacético tiene gran utilidad como exfoliativo de la queratina, por tanto es capaz de minimizar callosidades o granos sobre piel afectada con estas características.
Por otra parte, el ácido fenoxiacético es materia prima para la síntesis de plaguicidas, específicamente de herbicidas, tales como Astix y Duplosan.
Si el producto es accidentalmente ingerido causará irritación de las mucosas en todo el tracto gastrointestinal (boca, esófago, estómago e intestinos).
Si es inhalado producirá irritación de la mucosa respiratoria, provocando insuficiencia respiratoria y tos.
Sobre la piel puede causar irritación leve. Mientras que sobre la mucosa ocular la irritación será más severa. En estos casos se recomienda lavar con abundante agua y jabón la zona afectada y sobre la mucosa ocular lavar con abundante agua.
Este producto ha sido asociado como factor predisponente para el padecimiento o aparición de tumores adiposos. Estos tumores suelen desarrollarse más frecuentemente en las extremidades o en el abdomen.
Por otra parte, este producto es catalogado como no peligroso de transportar de acuerdo a los criterios descritos por la reglamentación del transporte.
Los plaguicidas derivados del ácido fenoxiacético si suelen ser tóxicos para el ambiente y han sido relacionados con las mutaciones genéticas, específicamente con la translocación t presentes en el linfoma no-Hodgkin en el humano.
– Este producto debe guardarse alejado de agentes oxidantes fuertes y bases con las que puede reaccionar violentamente.
– Es importante evitar el calentamiento de este producto.
– Manipular utilizando medidas de protección, como guantes, bata, lentes de seguridad.
- González G, Trujillo R. Ácido fenoxiacético, identificación y determinación de su acción antifúngica in vitro frente a Candida albicans y Trichophyton rubrum.Rev. Peruana de la Facultad de Farmacia, 1998; 34 (109). Disponible en: unmsm.edu
- «Ácido fenoxiacético». Wikipedia, la enciclopedia libre. 13 de mayo 2014, 5:21 pm UTC. 13 de mayo 2014, 17:21 wikipedia.org
- Laboratorios Merck. Ficha de datos de seguridad. 2017. Disponible en: ens.uabc.mx/
- Laboratorios Aventis. Hoja de datos de seguridad Aventis. 2001. Disponible en: afipa.cl
- Gutiérrez M. Fenoxiacéticos en Urgencias Toxicológicas. Centro de Información y Asesoría Toxicológica CIATOX. Universidad Nacional de Colombia. Disponible en: encolombia.com
- Sandoval M. (2015). Manual de Prácticas de Laboratorio Química Orgánica II. Universidad Nacional Autónoma de México Facultad de Química.
- Laboratorios Merck. Ficha de datos de seguridad de acuerdo al reglamento CE No. 1907/2006. 2015 Disponible en: ens.uabc.mx/
- Berzal-Cantalejo M, Herranz-Torrubiano A, Cuenca-González C. Tumor adiposo con síntomas de alarma. Rev Clín Med Fam 2015, 8 (3):246-250. Disponible en: scielo.isciii.es/scielo.
- Matheus T, Bolaños A. Micronúcleos: biomarcador de genotoxicidad en expuestos a plaguicidas. Salus, 2014; 18 (2):18-26. Disponible en: ve.scielo.org
