Termoquímica: concepto, qué estudia, leyes, aplicaciones

¿Qué es la termoquímica?
La termoquímica se encarga del estudio de las modificaciones caloríficas que se llevan a cabo en las reacciones entre dos o más especies químicas. Se considera como parte esencial de la termodinámica, que estudia la transformación del calor y otros tipos de energía para comprender la dirección en la que se desarrollan los procesos y cómo varía su energía.
Asimismo, es fundamental entender que el calor involucra el traspaso de energía térmica que se da entre dos cuerpos, cuando estos se encuentran a temperaturas distintas; mientras la energía térmica es la que se asocia al movimiento azaroso que poseen los átomos y moléculas.
Por lo tanto, como en casi la totalidad de las reacciones químicas se absorbe o libera energía por medio de calor, es de mucha relevancia el análisis de los fenómenos que suceden por medio de la termoquímica.
¿Qué estudia la termoquímica?
La termoquímica estudia los cambios de energía en forma de calor que se dan en las reacciones químicas o cuando ocurren procesos que implican transformaciones físicas.
En este sentido, hay que aclarar ciertos conceptos dentro del tema para una mayor comprensión del mismo.
Sistema
Por ejemplo, el término “sistema” se refiere al segmento específico del universo que se está estudiando, entendiéndose por “universo” la consideración del sistema y sus alrededores (todo lo externo a este).
Entonces, un sistema generalmente consta de las especies involucradas en las transformaciones químicas o físicas que ocurren en las reacciones. Estos sistemas se pueden clasificar en tres tipos: abierto, cerrado y aislado:

- Un sistema abierto es aquel que permite la transferencia de materia y energía (calor) con sus alrededores.
- En un sistema cerrado existe el intercambio de energía pero no de materia.
- En un sistema aislado no se presenta el traspaso de materia ni de energía en forma de calor. A estos sistemas también se les conoce como “adiabáticos”.
Leyes de la termoquímica
Las leyes de la termoquímica están íntimamente ligadas a la ley de Laplace y Lavoisier, así como a la ley de Hess, las cuales son las precursoras de la primera ley de la termodinámica.
El principio expuesto por los franceses Antoine Lavoisier (importante químico y noble) y Pierre-Simon Laplace (célebre matemático, físico y astrónomo) reseña que “la alteración en la energía que se manifiesta en cualquier transformación física o química tiene magnitud igual y de sentido contrario a la alteración en la energía de la reacción inversa”.
Ley de Hess
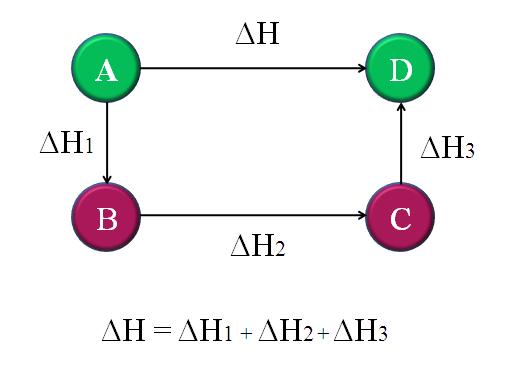
En el mismo orden de ideas, se tiene que la ley formulada por el químico ruso originario de Suiza, Germain Hess, es una piedra angular para la explicación de la termoquímica.
Este principio se basa en su interpretación de la ley de la conservación de la energía, que se refiere a que la energía no puede ser creada ni destruida, solo transformada.
La ley de Hess puede ser promulgada de esta manera: “la entalpía total en una reacción química es la misma, tanto si la reacción se lleva a cabo en un solo paso como si sucede en una secuencia de varios pasos”.
La entalpía total se da como la resta entre la sumatoria de la entalpía de los productos menos la sumatoria de la entalpía de los reactantes.
En el caso del cambio en la entalpía estándar de un sistema (en condiciones estándar de 25 °C y 1 atm), se puede esquematizar según la siguiente reacción:
ΔHreacción = ΣΔH(productos) – ΣΔH(reactantes)
Otra manera de explicar este principio, sabiendo que el cambio de entalpía se refiere al cambio de calor en las reacciones cuando estas se dan a una presión constante, es diciendo que el cambio en la entalpía neta de un sistema no depende del camino que se siga entre el estado inicial y el final.

Primera ley de la termodinámica
Esta ley está tan intrínsecamente enlazada a la termoquímica que a veces se confunde cuál fue la que inspiró la otra; así que, para dar luces sobre esta ley, se debe comenzar diciendo que también tiene sus raíces en el principio de conservación de la energía.
De manera que la termodinámica no solo toma en cuenta el calor como forma de transferencia de energía (como la termoquímica), sino que involucra otras formas de energía, como es el caso de la energía interna (U).
Así que la variación en la energía interna de un sistema (ΔU) está dado por la diferencia entre sus estados inicial y final (como se vio en la ley de Hess).
Tomando en consideración que la energía interna se compone por la energía cinética (movimiento de las partículas) y la energía potencial (interacciones entre las partículas) del mismo sistema, se pueden deducir que existen otros factores que contribuyen al estudio del estado y propiedades de cada sistema.
Aplicaciones de la termoquímica
La termoquímica tiene múltiples aplicaciones, a continuación se mencionarán algunas de estas:
- Determinación de los cambios de energía en determinadas reacciones mediante el uso de la calorimetría (medición de los cambios de calor en ciertos sistemas aislados).
- Deducción de los cambios de entalpía en un sistema, aun cuando estos no puedan conocerse por una medición directa.
- Análisis de las transferencias de calor producidas experimentalmente cuando se forman compuestos organometálicos con metales de transición.
- Estudio de las transformaciones de energía (en forma de calor) dadas en compuestos de coordinación de poliaminas con metales.
- Determinación de las entalpías del enlace metal-oxígeno de β-dicetonas y β-dicetonatos unidos a metales.
- Así como en las aplicaciones anteriores, la termoquímica se puede emplear para determinar una gran cantidad de parámetros asociados a otros tipos de energía o funciones de estado, que son las que definen el estado de un sistema en un momento determinado.
- La termoquímica también es utilizada en el estudio de numerosas propiedades de compuestos, como en la calorimetría de titulación.
Referencias
- Wikipedia. (s.f.). Thermochemistry. Recuperado de en.wikipedia.org
- Chang, R. (2007). Chemistry, Ninth edition. Mexico: McGraw-Hill.
- LibreTexts. (s.f.). Thermochemistry – A Review. Obtenido de chem.libretexts.org
- Tyagi, P. (2006). Thermochemistry. Recuperado de books.google.co.ve
- Ribeiro, M. A. (2012). Thermochemistry and its Applications to Chemical and Biochemical Systems. Obtenido de books.google.co.ve
- Singh, N. B., Das, S. S., y Singh, A. K. (2009). Physical Chemistry, Volume 2. Recuperado de books.google.co.ve
