Electrolito fuerte: concepto, características, ejemplos
Un electrolito fuerte es toda aquella sustancia que disuelta en agua, o en un solvente determinado, se disocia completamente en iones. Por lo tanto, no debe existir en solución como moléculas neutras, o como sólidos insolubles. Un electrolito fuerte puede tratarse de una sal, un ácido o una base, siempre que se disocien o ionicen completamente.
El ejemplo más representativo de un electrolito es la sal común, cloruro de sodio, NaCl. En solución acuosa los cristales de NaCl se disocian en su totalidad para producir iones Na+ y Cl–, que terminan rodeándose de moléculas de agua. Se dice entonces que una sal se comporta como un electrolito fuerte cuando su solubilidad es muy alta en agua.
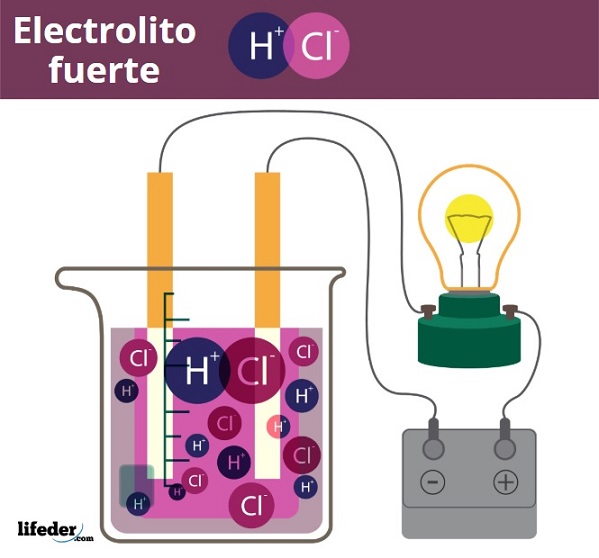
Un tanto similar es el caso de los ácidos y bases. Cuando estos son fuertes, sus disoluciones en agua producen la máxima cantidad posible de iones H3O+ u OH–, por lo que los cambios de pH son bruscos. Ejemplos de ácidos y bases fuertes son el ácido nítrico, HNO3, y el hidróxido de potasio, KOH, respectivamente.
Es importante saber identificar los electrolitos fuertes al momento de preparar soluciones muy iónicas, o medios ácidos o básicos muy fuertes.
Índice del artículo
- 1 Características de los electrolitos fuertes
- 2 Ejemplos de electrolitos fuertes
- 3 Diferencias entre electrolito fuerte y débil
- 4 Referencias
Los electrolitos fuertes se caracterizan por ser sustancias extremadamente solubles en agua. Sean sólidos o gases, al entrar en contacto con el agua no debe demorarse demasiado en disolverse por completo. Si una sal, por ejemplo, es poco soluble en agua, se puede descartar como electrolito fuerte.
Los electrolitos fuertes no solo son muy solubles en agua, sino que además generan una gran cantidad de iones. Gracias a las cargas eléctricas de estos iones, los electrones pueden recorrer cómodamente las disoluciones. Esto se refleja en un incremento en la conductividad iónica respecto al agua pura. Por eso las soluciones iónicas conducen muy bien la electricidad.
Muchos electrolitos fuertes salinos, al disolverse en agua, no producen ningún cambio de pH. Esto significa que las disoluciones de estas sales no son ácidas ni básicas, sino neutras, con un pH cercano a 7.
No obstante, puede haber sales ácidas o básicas que se disuelvan fácilmente en agua, y que generen además iones por completo. Por ejemplo, el carbonato de sodio, Na2CO3, se disuelve para generar iones Na+ y CO32-, pero el pH de la solución es básico.

Los electrolitos fuertes, al ser tantos, se dividen en tres clasificaciones: ácidos fuertes, bases fuertes, y sales solubles producto de las neutralizaciones entre los primeros dos.
Los ácidos fuertes al disolverse en agua, sin ningún problema, deben producir la máxima cantidad posible de H3O+, por lo que el ácido debe ionizarse por completo; es decir, no debe existir como molécula neutra con protones ácidos sin liberar.
Ejemplos de estos ácidos son:
-HCl, ácido clorhídrico, libera iones H3O+ y Cl–
-HF, ácido fluorhídrico, libera iones H3O+ y F–
-HNO3, ácido nítrico, libera iones H3O+ y NO3–
-HClO4, ácido perclórico, libera iones H3O+ y ClO4–
-HIO4, ácido peryódico, libera iones H3O+ y IO4–
-H2SO4, ácido sulfúrico, libera iones H3O+ y SO42-
La razón por la que el ion hidronio, H3O+, siempre está presente (de un modo u otro), es porque el hidrógeno que donan lo recibe una molécula de agua:
HCl + H2O → H3O+ + Cl–
La reacción es directa e irreversible. Esta es una característica de un ácido fuerte, que a su vez es un electrolito fuerte por causa de su ionización completa en agua.
Las bases fuertes, al disolverse en agua sin ningún problema, deben liberar iones OH– provenientes de sus mismos cristales, o desprotonar irreversiblemente una molécula de agua para generarlos.
Muchas bases fuertes consisten de sólidos iónicos y no moleculares. Algunos ejemplos de estas bases que se comportan como electrolitos fuertes son:
-LiOH, hidróxido de litio, libera iones OH– y Li+
-NaOH, hidróxido de sodio, libera iones OH– y Na+
-RbOH, hidróxido de rubidio, libera iones OH– y Rb+
-Ca(OH)2, hidróxido de calcio, libera iones OH– y Ca2+
-Sr(OH)2, hidróxido de estroncio, libera iones OH– y Sr2+
-Ba(OH)2, hidróxido de bario, libera iones OH– y Ba2+
-NaH, hidruro de sodio, libera iones OH– y gas hidrógeno, H2
-NaNH2, amiduro de sodio, libera iones OH– y gas amoníaco, NH3
Los electrolitos fuertes salinos al disolverse en agua deben ionizarse por completo. Muchos de ellos no producen cambios de pH. Esto se debe a que sus iones son muy estables, por lo que no participan en equilibrios de hidrólisis para cambiar la naturaleza del agua. Ejemplos de estas sales son:
-NaCl, cloruro de sodio, libera iones Na+ y Cl–
-AgNO3, nitrato de plata, libera iones Ag+ y NO3–
-NaNO3, nitrato de sodio, libera iones Na+ y NO3–
-K2SO4, sulfato de potasio, libera iones K+ y SO42-
-MgCl2, cloruro de magnesio, libera iones Mg2+ y Cl–
-CuSO4, sulfato cúprico, libera iones Cu2+ y SO42-
-KBr, bromuro de potasio, libera iones K+ y Br–
-NH4Cl, cloruro de amonio, libera iones NH4+, Cl–, H3O+ y gas amoníaco
-NaCN, cianuro de sodio, libera iones Na+ y CN–
-Na3PO4, fosfato de sodio, libera iones Na+ y PO43-
-CrCl3, cloruro crómico, libera iones Cr3+ y Cl–
-AuBr3, bromuro aúrico, libera iones Au3+ y Br–
-SnSO4, sulfato estañoso, libera iones Sn2+ y SO42-
El NH4Cl es un ejemplo contradictorio: se ioniza por completo, pero a la vez genera moléculas neutras de amoníaco por tratarse de una sal ácida.
Aunque de manera indirecta se han establecido las diferencias entre un electrolito fuerte de uno débil, estas se expondrán a continuación a modo de conclusión:
-Los electrolitos fuertes son muy solubles en aguas; los electrolitos débiles, no lo son.
-La ionización de un electrolito débil es parcial, lo que significa que puede haber moléculas neutras en solución. En cambio, los electrolitos fuertes existen en solución exclusivamente como iones.
-Los ácidos y bases débiles, que a su vez son electrolitos débiles, no se disocian por completo en agua, por lo que generan menos cantidad de iones H3O+ u OH– de lo que podría esperarse.
-Los electrolitos fuertes salinos casi no se hidrolizan en comparación a los electrolitos débiles. Por lo tanto, las disoluciones de los primeros tienden a ser neutras, exceptuando cuando se tratan de las sales ácidas o básicas.
- Whitten, Davis, Peck & Stanley. (2008). Química. (8va ed.). CENGAGE Learning.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2020). Strong electrolyte. Recuperado de: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (11 de febrero de 2020). Strong Electrolyte Definition and Examples. Recuperado de: thoughtco.com
- Chung & Chieh. (05 de junio de 2019). Electrolytes. Chemistry LibreTexts. Recuperado de: chem.libretexts.org
