Óxido de cloro (III): propiedades, estructura, usos
El óxido de cloro (III) es un compuesto inorgánico cuya fórmula química es Cl2O3. Corresponde al anhídrido del ácido cloroso, HClO2. Es un sólido de color café oscuro, altamente explosivo inclusive a temperaturas por debajo de los 0ºC, y pobremente caracterizado. Es por eso que es objeto de interés para estudios computacionales.
Químicamente se trata de un óxido covalente, por lo que existen enlaces Cl-O y una molécula discreta de Cl2O3 (imagen inferior). Dicha molécula bien puede formarse deshidratando el HClO2, o sometiéndolo a una fotólisis a bajas temperaturas. El detalle es que se descompone produciendo Cl2, O2, u otros óxidos de cloro termodinámicamente más estables.
Como los enlaces Cl-O son poco polares, la molécula de Cl2O3 tiene un momento dipolar pequeño; por lo tanto, no se disuelve bien en agua ni interactúa con otros solventes polares. Su inestabilidad es tal, que no se le conoce usos comerciales o potenciales (ni como explosivo sería viable su aplicabilidad).
La principal razón de su inestabilidad puede deberse a las características electrónicas del supuesto Cl3+ (asumiendo un carácter puramente iónico). De hecho, sus estados de oxidación +1 y +5 son los más estables cuando el cloro forma compuestos con el oxígeno.
Índice del artículo
Debido a que su caracterización es pobre y poco documentada, no hay mucho que decir de sus propiedades excepto los siguientes puntos:
-Tiene una masa molecular de 118,903.
-Es un sólido café oscuro; aunque puede sublimar cloro gaseoso, despidiendo vapores verdes amarillentos.
-Carece tanto de punto de ebullición como de fusión, ya que a 0ºC explota (y a temperaturas más frías también).
-Su solubilidad en agua se estima alrededor de 3,42 g/100 mL, lo cual comprueba que se trata de una molécula covalente de baja polaridad.
-Reacciona con el agua (lo poco que se disuelve) para convertirse en el HClO2:
Cl2O3 + H2O => 2HClO2
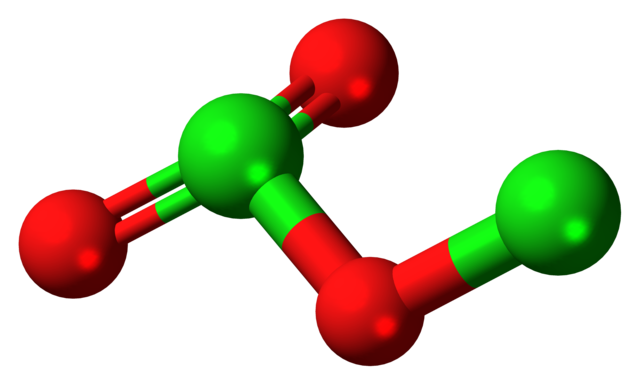
En la imagen se mostró la estructura molecular del Cl2O3 con un modelo de esferas y barras. Aunque no lo parezca a simple vista, las implicaciones tácitas de sus enlaces y arreglos espaciales son más complicadas de lo que aparentan. Esta estructura corresponde a una de los numerosos isómeros posibles para este compuesto.
Las esferas rojas corresponden a los átomos de oxígeno, y las verdes a los átomos de cloro. El cloro de la izquierda presenta geometría pirámide trigonal, con un par de electrones libres; por lo que puede suponerse que su hibridación debe ser sp3. Un átomo de oxígeno actúa como puente entre los dos cloros, Cl-O-Cl.
¿Cuáles son los otros isómeros? En teoría se calculan nueve, de los cuales cuatro son los más estables (entre ellos el de la imagen). Los otros tres vendrían a tener estructuras tales como:
-ClClO3. Muy similar a la explicada, pero con un enlace Cl-Cl.
-ClOOOCl(1). En este isómero hay un puente de tres oxígenos que separan a los dos átomos de cloro (recordar la geometría angular del H2O para visualizarlo).
-ClOOOCl (2). En este isómero también está presente el mismo puente oxigenado, con la salvedad de los dos átomos de cloro están eclipsados en el espacio; uno enfrente del otro, mientras que en el isómero anterior están distantes.
Su nombre, óxido de cloro (III), corresponde al asignado de acuerdo a la nomenclatura stock. Aquí se asume que el cloro posee un estado de oxidación de +3; pero no quiere decir que el catión Cl3+ pueda estar presente. Se trata de una molécula, no de una red de iones.
Otro nombre por el cual se conoce también al Cl2O3 es el trióxido de dicloro, de acuerdo a la nomenclatura sistemática.
Y por último, no tan común (pese a regirse por la nomenclatura tradicional), está el nombre anhídrido cloroso para referirse a este compuesto. Este nombre se debe a que, como ya se ha explicado, el Cl2O3 se produce cuando el HClO2 se condensa liberando agua.
Por tratarse de un óxido de cloro, el uso más inmediato que se podría pensar para el Cl2O3 es como un agente oxidante, capaz de neutralizar las impurezas orgánicas y microbios. Sin embargo, es muy inestable, además de explosivo, por lo que ni para este propósito se considera útil.
A ciencia cierta no hay información siquiera de cómo se comportaría el Cl2O3 bajo enormes presiones (si es que no explota en el proceso). En condiciones normales, pareciera no ser más que un intermediario relativamente estable y diferenciable entre otros óxidos de cloro más estables.
Computacionalmente, no obstante, ha sido objeto de estudio para determinar mecanismos por radicales libres que involucran varias especies de cloro y oxígeno.
- Shiver & Atkins. (2008). Química Inorgánica. (Cuarta edición). Mc Graw Hill.
- Wikipedia. (2019). Dichlorine trioxide. Recuperado de: en.wikipedia.org
- Dale L. Perry. (2011). Handbook of inorganic compounds. (second edition). CRC Press Taylor & Francis Group.
- Richard C. Ropp. (2013). Encyclopedia of the Alkaline Earth Compounds. ElSevier.
- Kim K. H., Han Y.K., and Lee Y. S. (1999). Basis set effects on the stability of the Cl2O3 isomers using B3P86 and B3LYP methods of density functional theory. Journal of Molecular Structure THEOCHEM 460(1-3):19-25.
