Porinas: características, función y ensamblaje
Las porinas son un tipo de proteínas integrales de membrana que permiten la difusión de diversos tipos de moléculas de mediano tamaño. Se encuentran en las membranas externas de bacterias gramnegativas (como en E. coli) y de mitocondrias y cloroplastos. Estas proteínas transmembranales traspasan por completo las membranas y su estructura se conforma por láminas β.
A diferencia de las proteínas transportadoras, las porinas son proteínas de canal, es decir, forman canales o poros abiertos que atraviesan la membrana donde se encuentre, permitiendo la difusión libre de moléculas con un tamaño y carga apropiados.
Índice del artículo
Las porinas son proteínas que crean canales transmembranales y, a diferencia de la mayoría de las proteínas que atraviesan una membrana, la porción que atraviesa dicha membrana esta constituida por láminas β en lugar de α hélices.
Estas proteínas integrales de membrana pueden carecer de una selectividad con respecto a las moléculas que pasarán a través de ellas, o pueden presentar ciertos grados de selectividad de tamaño y carga. Además pueden permitir el paso de moléculas más pequeñas que un tamaño determinado.
La región polar de la cadena de las porinas se encuentra en el interior recubriendo el canal acuoso, mientras que la porción apolar se proyecta al exterior del barril, interactuando con la región hidrofóbica de la bicapa lipídica de la membrana.
La difusión a través de los canales formados por estas proteínas obedece a un gradiente de concentración de la molécula o sustancia que atraviesa la membrana y es una difusión pasiva, es decir, no requiere energía metabólica para el movimiento de la sustancia.
Esta difusión es controlada por mecanismos específicos que pueden abrir o cerrar el canal y puede ser inhibida por varios compuestos.
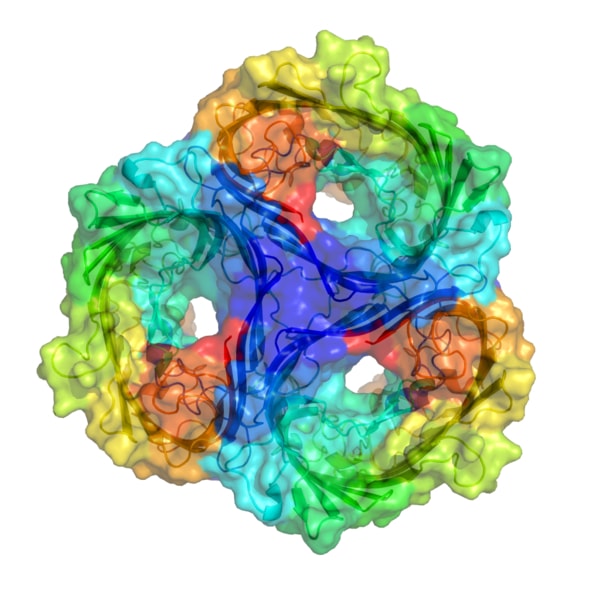
A finales de la década de 1980, mediante cristalografía de rayos X, se determinó por primera vez la estructura atómica de una porina, correspondiente a la membrana celular de Rhodobacter capsulatus que es una bacteria fotosintética.
Dicha porina consiste en un trímero, donde cada monómero forma un barril β con 16 láminas β que se enrollan entre sí, formando una estructura cilíndrica capaz de atravesar la membrana y que contiene un poro lleno de agua en su interior.
Diversos tipos de porinas han sido descritas desde entonces, tanto de células procariotas como de eucariotas. Todas ellas consisten en láminas β unidas que forman una estructura tipo barril β y un canal lleno de agua que puede medir entre 0,6 a 3nm de diámetro.
En las mitocondrias, las porinas constan de 19 láminas β que plegadas entre sí forman el barril β.
En muchas bacterias, las porinas están compuestas de entre 16 a 18 láminas β anti-paralelas que forman un barril β, presentando enlaces de hidrógenos entre las moléculas cercanas a lo largo de la cadena.
Las porinas de las bacterias y las membranas de mitocondrias y cloroplastos son funcionalmente similares, operando de una forma parecida, debido a su similitud en cuanto a las dimensiones de los poros, estructura atómica y propiedades de difusión pasiva.
El ancho del canal de las porinas se define por la alineación de polipéptidos en la pared interna de la estructura, permitiendo restringir el tamaño de las moléculas que pasaran a través de ellas.
La similitud de estas estructuras, refuerza la teoría endosimbiótica, según la cual la mitocondria de las células eucariotas proviene de un organismo procariótico que fue fagocitado por un precursor de célula eucariota.
En las células eucariotas se encuentran porinas en las membranas externas de mitocondrias y plástidos. Las porinas encontradas en los plástidos han sido muy poco estudiadas.
En el caso de las mitocondrias se conocen como porinas mitocondriales o canales aniónicos dependientes de voltaje (VDAC). Son canales amplios con un diámetro aproximado de 3nm que conforman el mayor constituyente proteico en las membranas externas. Representan alrededor del 30% del total de proteínas en esta membrana.
Generan permeabilidad a moléculas sin carga de hasta 5000 Da. Las porinas mitocondriales permiten el paso hacia el espacio intermembranal de moléculas pequeñas, iones y metabolitos.
Las moléculas e iones que atraviesan al espacio intermembranal no pasan por la membrana mitocondrial interna, ya que esta posee mayor impermeabilidad. Por ende, el espacio entre las dos membranas queda cargado de moléculas pequeñas e iones, siendo similar al citoplasma.
En las bacterias gramnegativas, una membrana externa les permite aislarse del ambiente como medida de protección. Dicha membrana contiene porinas permeables a los nutrientes requeridos por las bacterias.
Se pueden encontrar cerca de 100.000 porinas en la membrana de una célula procariota, representando alrededor del 70% del total de las proteínas en dicha estructura.
En las bacterias intestinales, la membrana externa representa una protección contra agentes dañinos externos como antibióticos, sales biliares y proteasas.
Las porinas aseguran la captación y eliminación de moléculas pequeñas hidrófilas, permitiendo así que la célula obtenga nutrientes necesarios para su correcto funcionamiento y pueda liberarse de los productos de desecho. En E. coli, las porinas permiten el paso de disacáridos, fosfatos y otras pequeñas moléculas.
Las porinas mitocondriales son importadas hasta las mitocondrias por un complejo proteico denominado TOM (traslocasa de la membrana mitocondrial externa) y son insertadas por el complejo SAM (maquinaria de clasificación y montaje de proteínas).
Muchos estudios han descrito como algunas proteínas de membrana externa de bacterias son importadas hasta las mitocondrias de células eucariotas por un mecanismo manejado por los complejos TOM y SAM, indicando que este proceso de inserción ha sido conservado entre los dos sistemas.
En las bacterias, las porinas se insertan por un complejo que posee la maquinaria de ensamblaje de los barriles β denominado BAM. Este complejo consta de cinco proteínas, cuatro de las cuales son lipoproteínas.
A pesar que el proceso de inserción de las porinas y sus estructuras son similares entre las células eucariotas y las procariotas, una diferencia notable es que, en las procariotas, para la inserción de estas estructuras se requiere la presencia de lipoproteínas.
Por otro lado, su ensamblaje en las membranas externas mitocondriales depende de la presencia de dos proteínas accesorias del complejo SAM: las proteínas Sam35 y Sam36.
- Alberts, B., Bray, D., Watson, J. D., Lewis, J., Roberts, K. & Raff, M. (2002). Molecular Biology of the cell. Fourth edition. Ed. Garland Science.
- Devlin, M. T. (1993). Texbook of Biochemistry With Chemical Correlations. Ed. John Wiley & Sons, Inc.
- Lodish, H. (2005). Biología celular y molecular. Ed. Médica Panamericana.
- Schirmer, T., & Rosenbusch, J. P. (1991). Prokaryotic and eukaryotic porins. Current Opinion in Structural Biology, 1(4), 539-545.
- Schulz, G. E. (1993). Bacterial porins: structure and function.Current Opinion in Structural Biology, 5(4), 701-707.
- Voet, D., & Voet, J. G. (2006). Bioquímica. Ed. Médica Panamericana.
- Zeth, K., & Thein, M. (2010). Porins in prokaryotes and eukaryotes: common themes and variations. Biochemical Journal, 431(1), 13-22.
